| ** | Latin American Journal of Clinical Sciences and Medical Technology is an open access magazine. To read all published articles and materials you just need to register Registration is free of charge. Register now If you already have registered please Log In | ** |
aLaboratorio de Análisis, Clínica de Mérida; bStar Médica Infantil; cInstituto Nacional de Ciencias Médicas y Nutrición “Salvador Zubirán”.
Autor para correspondencia: , . Números telefónicos: ; e-mail: miriam_lugo@clinicademerida.com.mx
Lat Am J Clin Sci Med Technol. 2025 Dec;7:180-189.
Recibido: 21 de noviembre, 2025
Aceptado: 03 de diciembre, 2025
Publicado: 11 de diciembre, 2025
Vistas: 56
Descargas: 0
Introducción. La toma de muestra capilar es una técnica esencial en el ámbito clínico. Se utiliza en neonatos, pediátricos y adultos cuando la venopunción no es viable o se requiere una muestra de bajo volumen. A pesar de su uso extendido, en muchos entornos mexicanos se realiza sin una estandarización formal, lo que puede comprometer la calidad del resultado y la seguridad del paciente. Objetivo. Estandarizar el procedimiento de toma de muestras capilares en México mediante la selección adecuada de dispositivos, técnicas seguras y condiciones óptimas, a fin de asegurar la calidad preanalítica y reducir complicaciones. Metodología. Se realizó una revisión de la literatura internacional y nacional vigente, así como el análisis comparativo de dispositivos de incisión y punción. Un grupo multidisciplinario participó en la elaboración de esta guía con base en la evidencia científica, las normas del CLSI (Clinical and Laboratory Standards Institute) y las recomendaciones de la Organización Mundial de la Salud (OMS). Resultados. La guía proporciona recomendaciones detalladas acerca de la selección de dispositivos según la edad y el sitio anatómico, las medidas de bioseguridad, los procedimientos diferenciados para la toma en dedo y en talón, las características del material de recolección, el orden de llenado, los criterios de exclusión y la prevención de complicaciones. Se destaca la superioridad de los dispositivos de incisión frente a los de punción en términos de menor dolor, menor hemólisis y mejor calidad de la muestra. Conclusiones. La implementación nacional de esta guía puede mejorar la calidad del diagnóstico clínico al reducir los errores preanalíticos, promover la seguridad del paciente y estandarizar la práctica del personal de salud.
Introduction. Capillary blood sampling is an essential technique in clinical practice. It is used in neonates, pediatric, and adult patients when venipuncture is not feasible or when only a small sample volume is required. Despite its widespread use, it is often performed without formal standardization in many healthcare settings in Mexico, which may compromise sample quality and patient safety. Objective. To standardize the capillary blood sampling procedure in Mexico by promoting appropriate device selection, safe techniques, and optimal conditions to ensure pre-analytical quality and minimize complications. Methods. A review of current international and national literature was conducted, along with a comparative analysis of incision and puncture devices. A multidisciplinary team developed this guideline based on scientific evidence, CLSI (Clinical and Laboratory Standards Institute) standards, and WHO (World Health Organization) recommendations. Results. The guideline provides detailed recommendations on device selection by age and anatomical site, biosecurity measures, differentiated procedures for finger and heel sampling, collection material specifications, order of draw, exclusion criteria, and prevention of complications. The superiority of incision devices over puncture devices is highlighted, particularly in terms of reduced pain, lower hemolysis rates, and improved sample quality. Conclusions. Nationwide implementation of this guideline may enhance the quality of clinical diagnostics by reducing pre-analytical errors, promoting patient safety, and standardizing practices among healthcare professionals.
La sangre capilar (o sangre obtenida por punción de la piel) es una mezcla de sangre de las arteriolas, vénulas y capilares, que también contiene líquido intersticial e intracelular. Este tipo de sangre refleja, en gran medida, la sangre arterial, especialmente cuando el área de punción ha sido previamente calentada.1
La toma de muestra de sangre capilar es un método de recolección de sangre, realizado por profesionales médicos de todos los niveles y disciplinas con diversos títulos, tales como flebotomistas, asistentes médicos, enfermeras, entre muchos otros.
La precisión de los resultados depende de la educación y de la estandarización de la técnica de la recolección de la muestra. La muestra es parte del paciente y debe ser tratada como tal, por lo que requiere de realizarla con paciencia, haber recibido educación al respecto y tener una buena técnica.
En septiembre de 2020, el Instituto de Estándares Clínicos y de Laboratorio (CLSI, Clinical and Laboratory Standards Institute) publicó los estándares para la toma de muestra capilar GP42, toma de muestras de sangre capilar (la primera revisión en 12 años). Sus estándares indican cómo llevar a cabo los procedimientos y procesos para garantizar la seguridad tanto del paciente como del profesional de salud responsable de recolectar la muestra. Desde luego, son importantes porque ayudan a reducir el riesgo de errores.2
La toma de muestra capilar es un procedimiento para obtención de muestras de sangre, que se ha empleado para el tamiz neonatal. Recientemente se ha implementado para estudios que requieren poca cantidad de muestras y en las pruebas al pie de la cama del paciente (POC).
En la mayoría de los hospitales y centros de atención médica se aplica este método de obtención de muestras sanguíneas, sin contar con un método estandarizado de referencia; y aunque es un procedimiento relativamente sencillo, no está exento de complicaciones y limitaciones.
Las pruebas donde se emplea sangre capilar son utilizadas habitualmente para controlar parámetros como glucosa, hba1c, colesterol (entre otros), en pacientes adultos.3
Los dispositivos de acceso capilar se utilizan para realizar punciones en la piel en pacientes de cualquier edad. Su propósito es realizar una punción o incisión en la piel de la persona, de manera segura y efectiva para conseguir un flujo adecuado de sangre.
Los dispositivos varían de acuerdo con el objetivo, tipo, calibre y profundidad. Cada uno de estos aspectos se relaciona con la cantidad de flujo de sangre que se obtendrá en el procedimiento.
Para que un dispositivo consiga flujo de sangre, se debe puncionar la dermis de la piel por lo menos a una profundidad de 0.6 a 1.3 mm. Ésta depende del grosor de la piel y de la circulación capilar de cada individuo. Por lo tanto, el tipo de dispositivo y sus características pueden repercutir significativamente en el flujo de la sangre y en la calidad de la muestra.4
Los dispositivos de acceso capilar varían en su habilidad de cortar o penetrar la piel y pueden producir flujos de sangre variables. Hoy en día, todos están diseñados para utilizarse una sola vez, por lo que numerosos fabricantes han incorporado dispositivos de seguridad, automatización y funciones para prevenir la exposición a patógenos transmitidos por la sangre.
El diseño de las características punzocortantes (tamaño, forma y afilado) se relaciona directamente con el desempeño del dispositivo. Hay tres características que determinan el propósito y flujo de sangre de cada dispositivo: calibre, ángulo y profundidad. 4
- Calibre o tamaño. Esta medida es diferente dependiendo del tipo de dispositivo. Para los dispositivos con punción de tipo aguja, la medida se expresa en «calibre», por ejemplo, 21G. Números menores de calibre significan mayor diámetro del punzocortante. Para dispositivos con cuchilla, el tamaño se mide en milímetros, por ejemplo, 2.0 mm.
- Ángulo. Representa el afilado del dispositivo. Ángulos pequeños generalmente significan dispositivos más afilados.
- Profundidad de penetración. Se determina por el tamaño de la aguja o cuchilla en relación con la penetración en la piel y se mide en milímetros.
Existen dos tipos generales de dispositivos para acceso capilar: de punción y de incisión (Figura 1).
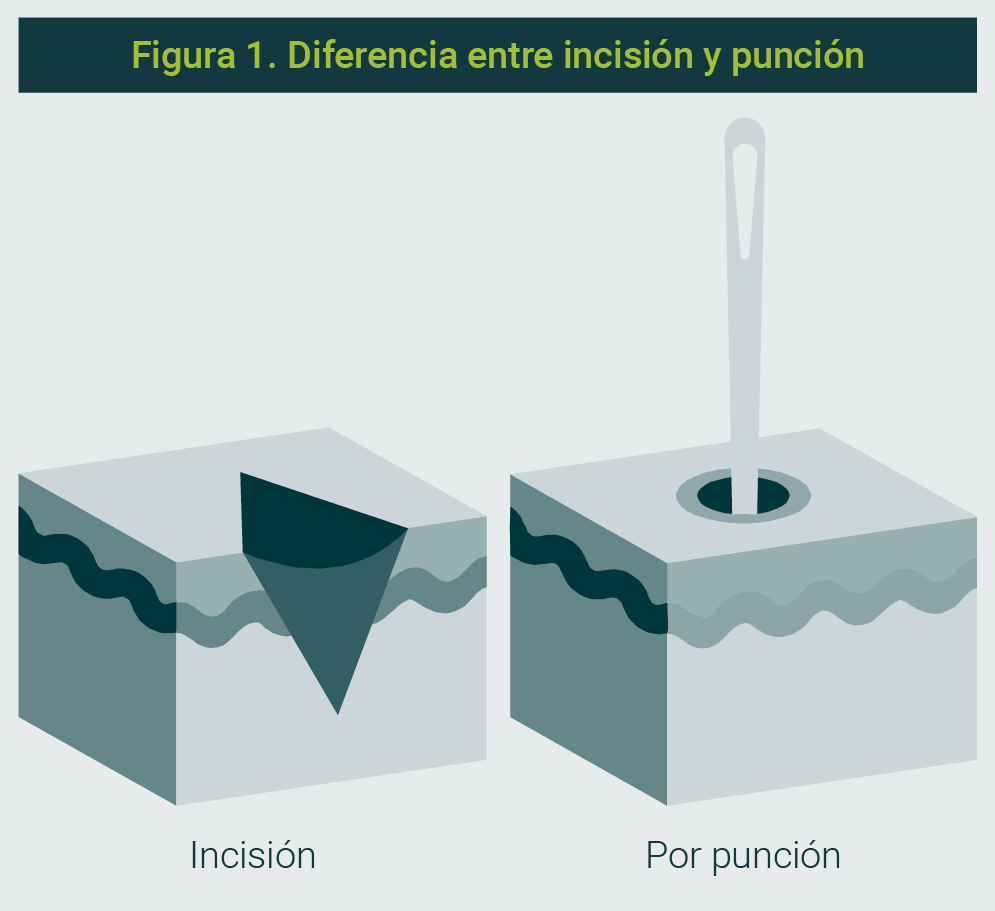
Dispositivos de punción (dispositivos de aguja)
Entre los dispositivos de acceso capilar, los de aguja son los más utilizados.5
Los primeros dispositivos de punción desarrollados fueron las lancetas de aguja manuales, cuyo principal objetivo era controlar la profundidad de la incisión, en comparación con las cuchillas quirúrgicas. Sin embargo, estas lancetas todavía presentaban un riesgo de incisión profunda y trauma en el talón del recién nacido, ya que requieren que el operador maneje la cuchilla manualmente.5-8
Tanto los desechos dérmicos como los venosos se pueden depositar en la herida, pueden causar que la muestra de sangre se contamine y sea inadecuada para el análisis clínico. Este problema es de mayor preocupación en recién nacidos prematuros o con alguna enfermedad, ya que reciben múltiples punciones durante las primeras semanas o meses de vida.7,8
Se ha registrado que el uso de lancetas convencionales produce celulitis, formación de abscesos, nódulos calcificados, pérdida de tejido, cicatrices e infecciones localizadas.9
Borris y Helleland reportaron el caso de dos niños de 12 y 7 años de edad, que presentaban deformidades persistentes de los pies, con hipoplasia del calcáneo.10
Otro estudio encontró deformidad del calcáneo en tres pacientes que habían desarrollado osteomielitis, posterior a la punción del talón neonatal para los estudios de sangre necesarios para los recién nacidos. Los investigadores atribuyeron esta condición a la infección en hueso, adquirida después de la punción del talón, realizada durante el período neonatal.11
Con los dispositivos de punción, el tiempo requerido para recolectar las muestras de sangre en recién nacidos para los estudios de laboratorio y las tasas de re-recolección de muestras son más altos.9
Posteriormente, se desarrollaron dispositivos semiautomáticos, pero presentaban el problema de que en muchas ocasiones el volumen de la toma de sangre obtenida era insuficiente para realizar los exámenes requeridos.6 Finalmente, se desarrollaron los dispositivos de punción automáticos con el fin de controlar la profundidad de la incisión.
Dispositivos de incisión
Recientemente se han introducido nuevos dispositivos para toma de muestra por talón12, entre ellos se encuentran los de tecnología de incisión, que fueron diseñados específicamente para la toma de muestra de sangre capilar en el talón en niños menores de un año.
Estos dispositivos utilizan una hoja de acero que corta en lugar de pinchar.7 La profundidad controlada de la incisión de estos dispositivos está diseñada para alcanzar los vasos sanguíneos de la dermis superficial y evitar las fibras de dolor dérmico más profundas.5,7 Además de disminuir el dolor y el estrés asociado con el uso de dispositivos de punción, los dispositivos de incisión reducen el riesgo de complicaciones como la osteomielitis porque penetran a una profundidad controlada y segura.
El área recomendada para realizar el acceso a sangre capilar es muy pequeña en los recién nacidos; por lo tanto, un dispositivo de incisión preciso que asegure una herida limpia con un adecuado flujo de sangre y que genere menos dolor es lo ideal para estos pacientes.8
Diversos estudios han demostrado que los dispositivos de incisión:
- son efectivos para proporcionar una muestra de calidad;
- reducen la tasa de repetición y el tiempo de toma de muestra;
- disminuyen la necesidad de exprimir el talón, los moretones posteriores a la toma de muestra y el dolor en los recién nacidos.
Además, se ha reportado que los dispositivos que realizan incisión en lugar de acción tipo guillotina son superiores.7,13,14
Otra ventaja al utilizar dispositivos de incisión es que permiten la recolección de muestras menos propensas a presentar hemólisis. La hemólisis in vitro se reconoce como una fuente frecuente de error en muchos análisis clínicos y representa la causa más común de rechazo de muestras en el laboratorio clínico.5 Ello es especialmente prevalente en muestras recolectadas de recién nacidos.
La hemólisis en muestras recolectadas por punción en el talón se ha atribuido en parte al trauma mecánico y a exprimir excesivamente el sitio de la punción. El análisis de muestras hemolizadas puede arrojar resultados equivocados, además de eventos adversos si se actúa con base en estos resultados.5
Los dispositivos de incisión producen menos moretones y hematomas que los de punción y también requieren de menos incisiones, punciones y tiempo de curación.9
Objetivos
Los objetivos de este documento son estandarizar los procedimientos para la toma de muestra capilar segura y confiable para el paciente y el personal de salud involucrado en el procedimiento, así como proporcionar una guía completa para su consulta, apoyo y aplicación de este proceso.
Alcance
Todo personal de salud calificado y entrenado para la toma de muestra en pacientes ambulatorios u hospitalizados en el sector público o privado o de cualquier institución y nivel de servicio de salud y/o auxiliar en el diagnóstico por laboratorio.
Justificación
Las punciones capilares pueden ser más adecuadas que la venopunción en ciertas situaciones. Realizar una venopunción en bebés puede ser difícil y peligroso porque tienen venas más pequeñas y tienden a moverse más que los pacientes adultos durante el procedimiento. Para pacientes pediátricos entre 6 y 12 meses de edad, la decisión de utilizar el dedo en lugar del talón debe basarse en el peso: en bebés que pesan más de 10 kg se puede usar el dedo si la profundidad de la lanceta no supera los 1.5 mm.2
Los pacientes adultos pueden requerir punción capilar debido a venas frágiles, superficiales o de difícil acceso, si se han sometido a múltiples punciones venosas sin éxito o si la prueba solicitada requiere de un pequeño volumen de sangre.
Otros pacientes que pueden requerir la extracción de sangre capilar incluyen pacientes quemados o geriátricos. Los pacientes con venas que están siendo preservadas para terapia intravenosa (IV) o si están recibiendo terapia IV en ambos brazos o manos también podrían beneficiarse de la punción capilar.2 Por lo tanto, es de gran utilidad para la realización de pruebas rápidas y cribados en salud pública y hospitales.
La elaboración de esta guía es de gran relevancia porque no existen lineamientos para la práctica de la toma capilar ni en México ni en Latinoamérica. Además, aún se requieren de consensos para fijar estándares y normas oficiales al respecto.
Metodología
Esta guía de práctica clínica se conformó gracias al trabajo de un grupo multidisciplinario y representativo de diversas áreas de atención, quienes realizaron búsquedas bibliográficas para la selección de las referencias con mayor evidencia y aplicabilidad para los objetivos de esta guía. Los especialistas se reunieron, analizaron la evidencia, detectaron y resolvieron los temas de controversia y llegaron a un consenso que dio lugar a las recomendaciones que se presentan en esta guía.
Solicitud de la prueba
Recomendación (R). En servicios de hospitalización y consulta externa, la solicitud debe estar completa. Los siguientes datos deben ser claros y legibles15:
- Datos demográficos
- Nombre completo del paciente
- Fecha de nacimiento
- Edad
- Sexo
- Estudios requeridos
R. Se debe verificar la solicitud del estudio, requisitada por el médico.
R. En caso de que la solicitud no sea clara, se recomienda localizar al médico para definirlo.
R. Evitar el uso de abreviaturas en las solicitudes para prevenir confusiones.
Identificación del paciente y de la muestra
R. Corrobore que la solicitud corresponde al paciente correcto, de acuerdo con la AESP 1 (acción esencial para la seguridad del paciente). Identifique correctamente al paciente bajo los siguientes lineamientos16:
- Nombre completo
- Fecha de nacimiento
- Sexo
- Pulsera de identificación (paciente hospitalizado)
R. Identificar la muestra con membrete o etiquetas que contengan la siguiente información:
- Nombre completo del paciente
- Fecha de nacimiento
- Fecha y hora de la toma de muestra
Selección del sitio de punción
Punción en el dedo anular y medio
La extracción de sangre capilar de los dedos es aceptable para adultos y niños mayores. Los dedos del recién nacido y bebés menores de seis meses no deben usarse para la extracción de sangre capilar porque la distancia desde la superficie del capilar hasta el hueso en la parte más gruesa del último segmento de cada dedo en los recién nacidos varía sólo de 1.2 a 2.2 mm.2
R. En los recién nacidos, la infección local y la gangrena también son posibles complicaciones de las punciones en los dedos. Para pacientes pediátricos entre 6 y 12 meses de edad, la decisión de utilizar el dedo en lugar del talón debe basarse en el peso. En bebés que pesan más de 10 kg (22 libras) se puede usar el dedo si la profundidad de la lanceta no supera los 1.5 mm.2
Punción en el talón
R. El método preferido para tomar muestras de sangre en recién nacidos a término es la venopunción, ya que el procedimiento de punción en el talón es más doloroso, menos eficiente, consume más tiempo y requiere más muestras. Al realizar punción en talón en recién nacidos, se deben utilizar medidas de alivio del dolor e involucrar a la madre siempre que sea posible, la lactancia materna y el contacto piel con piel son fundamentales.16
Una extracción de sangre capilar por punción en el talón requiere que el flebotomista considere la condición clínica del paciente, así como la edad y peso al elegir el sitio y una lanceta que ofrezca la profundidad de la punción. Las punciones de 2.0 mm de profundidad (o menos) proporcionarán un flujo sanguíneo adecuado sin riesgo de lesión ósea.2
Selección de material para recolección de la muestra
Los dispositivos de acceso capilar, utilizados para puncionar la piel, varían en función de su diseño, calibre, ángulo y profundidad. Ello determina el flujo y calidad de la muestra. Para una adecuada punción, deben alcanzar una profundidad de 0.6 a 1.3 mm, dependiendo del grosor de la piel y la circulación del individuo (Tabla 1).
| Tabla 1. Características del acceso recomendado | |||
|---|---|---|---|
| Edad | Sitio anatómico | Profundidad máxima del acceso | Dispositivo de acceso |
| Desde el nacimiento a 12 meses | Parte lateral del talón | No debe superar los 2.4 mm (OMS) 0.35 a 1.6 mm (CLSI GP42) 1 mm profundidad con 2.5 mm longitud (CLSI GP NBS01-A6) | Dispositivo de incisión |
| De 1 a 8 años | Incisión o punción en la superficie palmar del dedo anular de la mano no dominante | Profundidad 1.5 mm (OMS) | Dispositivo de incisión o punción |
| Mayor de 8 años y adulto | Punción en la superficie palmar del dedo anular de la mano no dominante | Referencia a las características del fabricante y requerimientos de la cantidad de muestra de laboratorio. (CLSI GP42) No debe superar los 2.2 mm (OMS) | Dispositivo de punción |
| La tabla es propiedad de los autores. | |||
Los dispositivos de incisión ofrecen menor hemólisis, muestras de mayor calidad, menos dolor; también reducen el tiempo y la repetición del procedimiento. La hemólisis, frecuente en muestras de recién nacidos, puede alterar los resultados clínicos y se asocia al trauma mecánico y a la manipulación excesiva del sitio de punción.
R. Se deben seguir las instrucciones del fabricante para la selección del dispositivo retráctil.
R. De acuerdo con el CLSI, la punción deberá realizarse con un dispositivo estéril, de un solo uso y retráctil para reducir accidentes.2 No utilice una cuchilla quirúrgica para realizar la punción.17
Este tipo de dispositivos está diseñado para que el paciente tenga mejores experiencias y para que el personal de salud minimice el riesgo de punciones accidentales. Se encuentran disponibles varios dispositivos retractiles en el mercado. Algunos de estos productos están diseñados para controlar la longitud y profundidad de la incisión.
R. Se recomienda que quienes evalúen los productos para los procedimientos en los pacientes sean los flebotomistas o personal del área de la salud que se dedican diariamente a realizar procedimientos. Los fabricantes proporcionan las indicaciones de instrucciones de uso, las cuales deben leerse, entenderse y seguir al pie de la letra para poder evaluar correctamente el producto y mostrar evidencia de los resultados obtenidos. Esta acción a nivel nacional ayudará a tomar mejores decisiones médicas en el laboratorio clínico.
R. Debido a que a menudo es imposible saber qué muestras pueden ser infecciosas, todas deben tratarse como potencialmente infecciosas y manejarse de acuerdo con precauciones estándar. Por lo tanto, se recomienda consultar los procedimientos de bioseguridad en Guía de práctica clínica para la bioseguridad en la toma de muestras en México, 2022.16
Proceso de toma de muestra
R. Verificar antes del proceso de toma de muestra que se cuenta con el siguiente material:
- Guantes
- Cubrebocas
- Gasas estériles
- Toallitas de alcohol
- Dispositivo de incisión retráctil
R. Llevar a cabo lavado de manos, colocar guantes, realizar asepsia en el sitio seleccionado con alcohol isopropílico al 70% y dejar secar por lo menos 30 segundos para proporcionar una desinfección efectiva (CLSI GP41 V7), con la finalidad de minimizar la contaminación microbiológica de la muestra y la infección del paciente.
R. Permitir que el sitio se seque, sin limpiarlo, favorece una descontaminación óptima al tiempo que reduce la posibilidad de interferir con la muestra y evita que el paciente experimente una sensación de ardor cuando se realiza la punción.2
Toma de muestra de sangre capilar en dedo
Manejo de pacientes pediátricos17
R. Primero inmovilice al niño, pidiéndole a los padres que:
- Se sienten en la silla de flebotomía con el niño en el regazo.
- Inmovilicen las extremidades inferiores del niño, coloquen sus piernas alrededor de las del niño en un patrón de piernas cruzadas.
- Extiendan un brazo sobre el pecho del niño y aseguren el brazo libre del niño metiéndolo firmemente debajo del suyo.
- Sujeten el codo del niño (es decir, el brazo de la punción en la piel) y lo sostengan firmemente.
- Usen su otro brazo para sujetar firmemente la muñeca del niño, y que la sostengan con la palma hacia abajo.
Manejo de pacientes adultos18
R. Tomar la muestra de la mano no dominante para evitar zonas callosas, que son potencialmente más sensibles al dolor debido a que tienen más terminaciones nerviosas.
R. Se deben considerar las siguientes indicaciones y recomendaciones cuando la toma de muestra de sangre capilar se realiza en un dedo:
- La punción debe realizarse en la superficie con la palma hacia arriba, en el segmento distal del dedo medio o anular (punta del dedo) (Figura 2).
- La punción debe realizarse a un lado de la yema del dedo, donde la profundidad del tejido es suficiente para evitar lesiones óseas.
- La incisión debe realizarse de manera transversal con respecto a la dirección de la huella digital, con la finalidad de que se formen grandes gotas de sangre; de lo contrario, la sangre correrá por los surcos de la huella, lo cual ocasionará contaminación y desperdicio de sangre.2
- Evitar tomar muestras en:
- El dedo meñique porque la profundidad del tejido es insuficiente para prevenir lesiones óseas.
- En el pulgar o el índice porque estos son más sensibles que otros dedos y pueden tener callos o cicatrices.
- En sitios inflamados o previamente perforados porque el líquido tisular acumulado contamina la muestra de sangre.
- Pacientes con mastectomía bilateral.16
- Áreas con cicatrices extensas, quemaduras curadas, sitios inflamados, sitios edematosos, sitios de punción previa, lóbulos de las orejas y pulgares.19
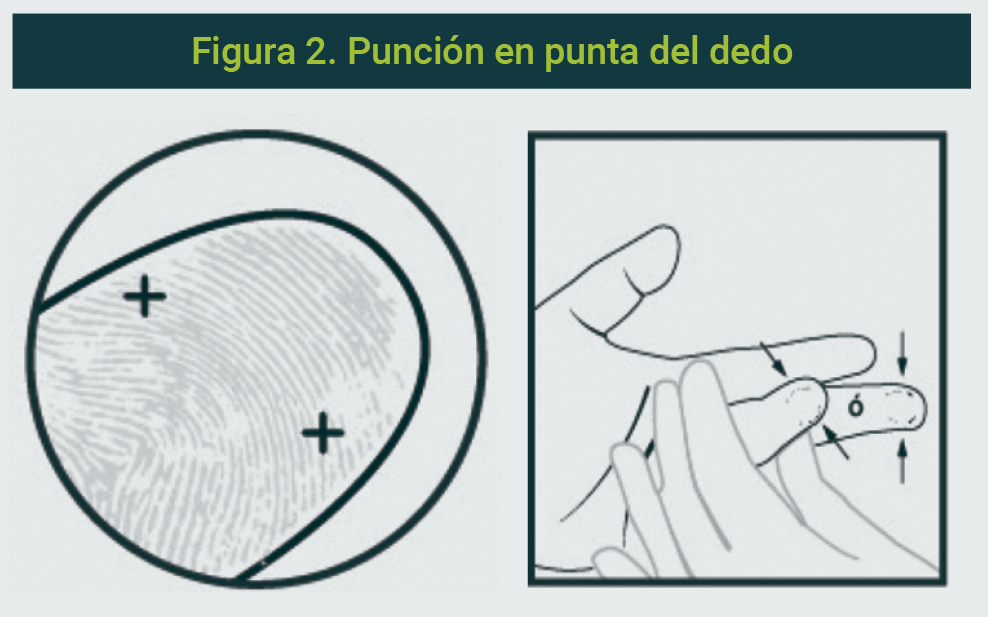
La figura es propiedad de los autores.
R. Se debe tener cuidado de no acortar la distancia entre la piel y el hueso mientras se comprime el tejido antes de la activación del dispositivo retráctil.2
Toma de muestra de sangre capilar en talón
Recomendaciones previas
R. Calentar el sitio aumenta el flujo de sangre arterial al sitio hasta siete veces y no quemará la piel si se calienta a una temperatura no superior a 42 grados centígrados. Aunque los estudios muestran que el precalentamiento puede no ser necesario cuando se usa un dispositivo de incisión, el aumento del flujo sanguíneo capilar mediante el precalentamiento puede minimizar la necesidad de ejercer presión adicional en el sitio.2
R. Con la finalidad de evitar reacciones alérgicas al látex o quemaduras, se recomienda el uso de cojines térmicos diseñados para este tipo de toma de muestra19 (Figura 3).
R. Seguir una guía con ubicaciones adecuadas implica menor riesgo de perforar el hueso del talón. Si las superficies lateral y medial del talón han sido perforadas repetidamente o si los hematomas son extensos en esta área es posible que se deba considerar una venopunción.
Procedimiento
- Después de realizar asepsia en el sitio seleccionado, sujete el talón con los dedos pulgar e índice.
- Coloque el dispositivo de incisión en el talón (según el fabricante) considerando áreas de punción.
- Presione de forma intermitente el talón para favorecer la formación de gota (no exprima la zona).2
- Evite apretar demasiado el dedo o talón porque esto diluye la muestra con líquido tisular (plasma) y aumenta la probabilidad de hemólisis.
R. Deseche la primera gota porque puede estar contaminada con líquido tisular o desechos (piel desprendida).17
R. Mezcle cuidadosa y periódicamente la muestra durante la recolección para evitar la coagulación.
R. Puede ser necesario presionar suave e intermitente para obtener una muestra adecuada. La presión debe liberarse entre gotas para permitir que los lechos capilares se rellenen y se repita hasta alcanzar el volumen de muestra requerido.
R. Recolecte la muestra, según orden de tubos.
Dispositivos para recolectar las muestras
Microtubos
R. Se recomienda el uso de tubos de plástico por razones de seguridad.
R. El interior del tubo debe ser estéril.
R. El color del material debe permitir la observación del interior, a menos que la luz UV altere algún metabolito contenido en la sangre.
R. El tapón debe permitir la fácil apertura y cierre para mejorar la recolección.
R. El tubo debe contener datos de lote y fecha de caducidad.
R. El tubo debe contener marcas de llenado máximo y mínimo.
R. El color del tapón debe cumplir con el código de colores indicado por la norma ISO 6710.20
Llenado y homogeneización del tubo
R. Hay razones importantes para seguir el orden de extracción de sangre capilar. Comenzar con el tubo de EDTA garantiza que la sangre no comience a coagularse antes que se recolecte la muestra.
R. La cantidad de muestra recolectada en el dispositivo debe cumplir con el mínimo y el máximo de llenado marcado en el tubo.
R. Si el tubo de recolección contiene aditivos, el tubo debe homogeneizarse inmediatamente para evitar la formación de coágulos (ver instrucciones del fabricante).
Papel filtro para muestras de tamiz neonatal
Existen varios tipos de papel filtro disponibles en el mundo y acreditados por los organismos internacionales para la toma del tamiz neonatal. Es un papel 100% de algodón puro de calidad controlada para absorción (peso básico 185 g/m², grosor 0.545 mm, absorción en agua 4.7ml/100 cm², cenizas 0.06%, densímetro 3.0 seg y superficie medio suave) para lograr una recolección uniforme de las muestras de gotas de sangre, por lo que ha sido seleccionado en casi todos los países como el medio ideal para este fin.21
La ventaja de este papel es que el algodón es un medio de transporte inerte, permite la recolección uniforme, conserva la sangre y la elución posterior de los analitos.
Actualmente, la tarjeta de Guthrie suele unirse a la ficha de identificación con los datos relevantes del binomio madre/hijo; la información de identificación y la muestra siempre están juntas.22
La simplicidad en la recolección de la sangre, transporte y almacenamiento hacen del sistema de recolección de gotas de sangre seca una alternativa económica para muchas aplicaciones clínicas.
Sin embargo, los papeles filtro de mala calidad o con fecha de caducidad vencida2 y las muestras recolectadas de manera inapropiada pueden alterar significativamente los resultados de pruebas como el tamiz neonatal. Ello deriva en pobres resultados del análisis, riesgo de perder casos positivos y retrasos en la obtención de resultados y de conformación de un diagnóstico preciso. En consecuencia, sería necesario reemplazar la muestra.
Las características y especificaciones de papeles filtro para tamiz neonatal pueden consultarse en la guía del CLSI dedicada a los procedimientos preanalíticos de tamiz neonatal.2
Orden de recolección
R. El orden de extracción es el siguiente2:
- Gasometría capilar
- Tubo de EDTA
- Capilar, también conocido como pajilla para VSG. Sostenga el tubo capilar en un ligero ángulo hacia arriba para evitar que entren burbujas de aire en el tubo (es un detalle preciso e importante para incluir en una técnica estandarizada).
- Tubo de química u obtención de suero2
R. Coloque una gasa seca en el sitio de punción.
R. Identifique y transporte las muestras al área de proceso.
Cuidado posterior a la recolección
- Es importante aplicar presión en el sitio después de completar la recolección y elevar ligeramente la extremidad hasta que se detenga el sangrado. Continúe observando el sitio y al paciente para asegurarse que no es necesario informar ningún efecto adverso.
- Etiquete la muestra inmediatamente después de la recolección y en presencia del paciente.
Complicaciones del paciente tras la toma de muestra
Las complicaciones que pueden surgir en el muestreo capilar incluyen17:
- Colapso de las venas si la arteria tibial se lacera por la punción de la cara media del talón.
- Osteomielitis del hueso del talón (calcáneo).
- Daño a los nervios, si se perforan los dedos de los recién nacidos.
- Hematoma y pérdida de acceso a la rama venosa utilizada.
- Cicatrización.
- Necrosis localizada o generalizada (a largo plazo).
- Ruptura de la piel por el uso repetido de tiras adhesivas (particularmente en pacientes muy jóvenes o geriátricos); esto se puede evitar si se aplica suficiente presión y se observa el sitio de punción después del procedimiento.
Contraindicaciones de la punción capilar6
Las condiciones clínicas o estados fisiológicos que pueden afectar negativamente la toma de muestras capilares (o pueden estar contraindicadas) son:
- Pacientes
- severamente deshidratados;
- con mala circulación (la presión arterial baja con mala circulación periférica puede complicar la recolección de muestra capilar);
- que requieren pruebas de coagulación con plasma;
- para quienes los exámenes requieren grandes volúmenes de sangre (hemocultivos);
- que presentan una ulceración, piel callosa o una ampolla en el sitio elegido para punción;
- con trombocitopenia y/o plaquetas anormales;
- con edema periférico.
Nota. El líquido tisular puede contaminar o diluir las muestras de sangre.
Pacientes con otras condiciones físicas o enfermedades específicas pueden necesitar el uso de métodos alternativos para obtener la muestra de sangre.
La estandarización de la toma de muestra capilar en México, basada en evidencia científica actual, en lineamientos internacionales (CLSI, OMS) y en la experiencia multidisciplinaria de expertos nacionales, representa un paso importante para mejorar la calidad preanalítica y la seguridad del paciente en todos los niveles del sistema de salud.
La literatura revisada demuestra, de manera consistente, que la selección adecuada del dispositivo (especialmente el uso de tecnologías de incisión en poblaciones pediátricas y neonatales) reduce el dolor, disminuye la hemólisis, evita complicaciones graves como osteomielitis o deformidades del calcáneo y mejora significativamente la calidad y reproducibilidad de la muestra.
La presente guía integra recomendaciones prácticas, claras y aplicables para profesionales de la salud con distintos niveles de formación, lo que favorece una implementación homogénea en hospitales públicos, privados y unidades ambulatorias. Su adopción nacional permitirá disminuir la variabilidad técnica actual, reducir la tasa de repetición de muestras, acortar tiempos de proceso, optimizar recursos y fortalecer la confiabilidad diagnóstica, particularmente en pruebas críticas como tamiz neonatal, hematología básica y determinaciones punto de cuidado.
Finalmente, la guía abre la puerta al desarrollo continuo de competencias en el personal de salud, promueve una práctica segura y calidad acorde con los estándares internacionales. Su implementación sostenida no sólo contribuirá a mejorar los resultados clínicos, la experiencia del paciente y la eficiencia operativa de los laboratorios en México, sino que establecerá las bases para futuras actualizaciones basadas en innovación tecnológica y nueva evidencia científica.
Agradecemos al MF QFB José Antonio Duarte García por el apoyo logístico necesario para llevar a cabo esta guía de práctica clínica.
Los autores no refieren ningún conflicto de interés.
| 1. | Chattás G, Egan F. Extracción de sangre: punción capilar de talón. Enf Neol. 2007;1(3):24-27. [Consultado el 2 de diciembre, 2025]. Disponible en URL: https://ia902308.us.archive.org/0/items/extracciones-de-sangre-puncion-capilar-de-talon/Extracciones%20de%20sangre%20Punci%C3%B3n%20capilar%20de%20tal%C3%B3n.pdf |
| 2. | Clinical and Laboratory Standards Institute. GP42. Collection of capillary blood specimens. 7th edition. CLSI standard GP42. ISBN 978-1-68440-091-1 (eBook), 978-1-68440-090-4 (Print). Clinical and Laboratory Standards Institute, USA, 2020. |
| 3. | Serafin A, Malinowski M, Parzmowoska-Wilanowska A. Blood volume and pain perception during finger prick capillary blood sampling: Are all safety lancets equal? Postgrad Med. 2020;132(3):288-95. |
| 4. | Springer L. Lancets recommended by PTS, Inc. Cardiocheck PA Technical Bulletin. 2009. [Retrieved on December 2nd, 2025]. Available from URL: https://www.cliawaived.com/amfile/file/download/file/1031/product/4640/ |
| 5. | Kazmierczak SC, Robertson AF, Briley KP. Comparison of hemolysis in blood samples collected using an automatic incision device and a manual lance. Arch Pediatr Adolesc Med. 2002;156(11):1072-4. |
| 6. | Burns ER. Development and evaluation of a new instrument for safe heel stick sampling of neonates. Lab Med. 1989;20(7):481-3. |
| 7. | Folk LA. Guide to capillary heelstick blood sampling in infants. Adv Neonatal Care. 2007;7(4):171-8. |
| 8. | Paes B, Janes M, Vegh P, LaDuca F, Andrew M. A comparative study of heel-stick devices for infant blood collection. Am J Dis Child. 1993;147(3):346-8. |
| 9. | Kellam B, Sacks LM, Wailer JL, Kathen C, McLaurin C, Doster C, et al. Tenderfoot preemie vs a manual lancet: A clinical evaluation. Neonatal Netw. 2001;20(7):31-6. |
| 10. | Borris LC, Helleland H. Growth disturbance of the hind part of the foot following osteomyelitis of the calcaneus in the newborn: A report of two cases. J Bone Joint Surg Am. 1986;68(2):302-5. |
| 11. | Abril Martin JC, Aguilar Rodriguez L, Albiñana Cilveti J. Flatfoot and calcaneal deformity secondary to osteomyelitis after neonatal heel puncture. J Pediatr Orthop B. 1999;8(2):122-4. |
| 12. | Vertanen H, Fellman V, Brommels M, Viinikka L. An automatic incision device for obtaining blood samples from the heels of preterm infants causes less damage than a conventional manual lancet. Arch Dis Child Fetal Neonatal Ed. 2001;84(1):F53-5. |
| 13. | Cavanagh C, Coppinger C. Newborn blood spot sampling. Infant. 2009;5(3):168-71. [Retrieved on December 2nd, 2025]. Available from URL: https://www.infantjournal.co.uk/pdf/inf_027_bss.pdf |
| 14. | Hammermeister M, Baskin L, Lemaire C, Naugler C. Comparison of two infant lancet devices on ease of use and post-lance bleeding times. J Neonatal Nurs. 2013;19(2):71-5. |
| 15. | Contreras Perea JC, Galindo Fraga A, Huertas Jimenez MA, Muñoz Pedraza A, Teran Soto JM. Guía de práctica clínica para toma de muestras de gases en sangre en México. Lat Am J Clin Sci Med Technol. 2022;4:121-33. |
| 16. | Huertas Jiménez MA, Galindo Fraga A. Guía de práctica clínica para la bioseguridad en toma de muestras en México. Lat Am J Clin Sci Med Technol. 2022;4:39-48. |
| 17. | World Health Organization. WHO guidelines on drawing blood: Best practices in phlebotomy. Geneva: World Health Organization; 2010. Chapter 2, Best practices in phlebotomy. [Retrieved on December 2nd, 2025]. Available from URL: https://www.ncbi.nlm.nih.gov/books/NBK138665/ |
| 18. | Krleza JL, Dorotic A, Grzunov A, Maradin M; Croatian Society of Medical Biochemistry and Laboratory Medicine. Capillary blood sampling: National recommendations on behalf of the Croatian Society of Medical Biochemistry and Laboratory Medicine. Biochem Med (Zagreb). 2015 ;25(3):335-58. |
| 19. | Clinical and Laboratory Standards Institute. Collection of diagnostic venous blood specimens. 7th ed. CLSI standard GP41. Wayne, PA: CLSI; 2017.[Retrieved on December 2nd, 2025]. Available from URL: https://webstore.ansi.org/preview-pages/CLSI/preview_CLSI+GP41-Ed7.pdf |
| 20. | 20.International Organization for Standardization (ISO). Medical laboratories – Single use containers for human venous blood specimen collection. ISO 6710. Geneva: ISO; 2017. [Retrieved on December 2nd, 2025]. Available from URL: https://www.iso.org/obp/ui/en/#iso:std:iso:6710:ed-2:v1:en |
| 21. | Kuru Kan Karti. Dry blood spot. Whatman™ neonatal screening cards–capabilities. Cytiva; [Retrieved on December 2nd, 2025]. Available from URL: https://www.kurukankarti.com/wp-content/uploads/2021/08/whatman-903.pdf |
| 22. | Hannon WH, Whitley RJ, Davin B, Fernhoff P, Halonen T, Lavochkin M. Blood collection on filter paper for newborn screening programs: approved standard – fifth edition. CLSI document LA04-A5. Wayne, PA: Clinical and Laboratory Standards Institute; 2007. 27:1-13. |
All Rights Reserved® 2019
Latin American Journal of Clinical Sciences and Medical Technology,Publicación contínua • Editor responsable: Gilberto Castañeda Hernández. • Reserva de Derechos al Uso Exclusivo: 04-2019-062013242000-203; ISSN: 2683-2291; ambos otorgados por el Instituto Nacional del Derecho de Autor. • Responsable de la última actualización de este número, Web Master Hunahpú Velázquez Martínez,
Calle Profesor Miguel Serrano #8, Col. Del Valle, Alcaldía Benito Juárez, CP 03100, Ciudad de México, México. Número telefónico: 55 5405 1396 • Fecha de última modificación, 28 de agosto de 2024.
All Rights Reserved® 2019
Publicación contínua • Editor responsable: Gilberto Castañeda Hernández. • Reserva de Derechos al Uso Exclusivo: 04-2019-062013242000-203; ISSN: 2683-2291; ambos otorgados por el Instituto Nacional del Derecho de Autor. • Responsable de la última actualización de este número, Web Master Hunahpú Velázquez Martínez,
Calle Profesor Miguel Serrano #8, Col. Del Valle, Alcaldía Benito Juárez, CP 03100, Ciudad de México, México. Número telefónico: 55 5405 1396 • Fecha de última modificación, 28 de agosto de 2024.