| ** | Latin American Journal of Clinical Sciences and Medical Technology is an open access magazine. To read all published articles and materials you just need to register Registration is free of charge. Register now If you already have registered please Log In | ** |
aCirugía Oncológica, Departamento de Tumores Gastrointestinales, Instituto Nacional de Cancerología, Ciudad de México, México; bOncología Médica, Departamento de Tumores Gastrointestinales, Instituto Nacional de Cancerología, Ciudad de México, México; cRadioterapia, Departamento de Tumores Gastrointestinales, Instituto Nacional de Cancerología, Ciudad de México, México; dDepartamento de Nutrición, Instituto Nacional de Cancerología, Ciudad de México, México..
Autor para correspondencia: , . Números telefónicos: ; e-mail: dr.albertotakahashi@gmail.com
Lat Am J Clin Sci Med Technol. 2022 Dec;4:183-197.
Recibido: 06 de diciembre, 2022
Aceptado: 20 de diciembre, 2022
Publicado: 23 de diciembre, 2022
Vistas: 23351
Descargas: 219
El cáncer de esófago y de la unión esofagogástrica (UEG) se encuentra entre los diez principales tumores en incidencia y mortalidad a nivel mundial. México no es la excepción; su incidencia va en aumento, sobre todo para el adenocarcinoma, por lo que debemos tener conocimiento de esta enfermedad. En el Departamento de Tumores Gastrointestinales del Instituto Nacional de Cancerología hemos elaborado esta oncoguía mediante un manejo multidisciplinario. Abordamos aspectos epidemiológicos, criterios para diagnóstico, estadificación, correcta diferenciación de un tumor esofágico y de UEG, además de las múltiples opciones de tratamiento por etapa clínica con la evidencia más reciente, incluido el abordaje nutricional, fundamental en estos pacientes.
Cancer of the esophagus and gastroesophageal junction (GEJ) is among the top ten tumors in incidence and mortality worldwide. Mexico is not the exception; the incidence is increasing, especially for adenocarcinoma, so we must be aware of this disease. In the Department of Gastrointestinal Tumors from Instituto Nacional de Cancerología, we have developed these onco-guidelines through multidisciplinary management. We review epidemiological aspects, criteria for diagnosis, staging, correct differentiation of an esophageal tumor and EGJ, and the multiple treatment options by stage clinic with the most recent evidence including the nutritional approach that is very important in these patients.
El objetivo de esta oncoguía es mostrar sugerencias y recomendaciones con la evidencia científica más reciente y la experiencia del Departamento de Tumores del Tubo Digestivo del Instituto Nacional de Cancerología (INCan) para el diagnóstico y tratamiento de pacientes con cáncer en el esófago y de la unión esófago-gástrica (UEG).
Epidemiología
A nivel mundial, el cáncer de esófago ocupa el séptimo lugar en incidencia (con 604,000 casos diagnosticados en 2020) y el sexto lugar en mortalidad (544,000 defunciones estimadas en 2020). Ello nos refiere una alta letalidad y supervivencia baja de apenas 20% a 5 años.1
Se diagnostica con frecuencia en los hombres (70%); hay de dos a tres veces de diferencia en incidencia y mortalidad entre el género masculino y femenino. Cabe mencionar que se está observando un incremento en la incidencia para adenocarcinoma en menores de 50 años y que se presentan en etapas más avanzadas.2 El INCan, entre 2011 y 2021, ingresó 617 pacientes con cáncer de esófago y UEG; el género masculino predominó en el 81% y la media de edad fue de 60.7±12.3 años. La histología más frecuente fue adenocarcinoma intestinal (46.7%), seguido del carcinoma epidermoide (34.7%). Se observó una alta incidencia de tumores avanzados donde la principal etapa clínica fue IVB (52.7%), seguido de la etapa III (34.5%) y la media de supervivencia fue de 19.1 (95%CI, 16.4-21.9) meses con una supervivencia global (SG) de 30.8%.3
Factores de riesgo
Es de importancia considerar que hay dos histologías diferentes y que los factores de riesgo son:
- Carcinoma epidermoide. Consumo de tabaco y alcohol (principales factores); secundariamente el antecedente de un tumor en cabeza y cuello o pulmón, acalasia, lesiones por cáusticos, tilosis, infección por virus del papiloma humano 16 y 18, nivel socioeconómico bajo y una dieta limitada en frutas y verduras.
- Adenocarcinoma. El principal factor de riesgo es el esófago de Barrett que incrementa de 30 a 120 veces el riesgo y está asociado con la enfermedad por reflujo gastroesofágico y obesidad. También el género masculino y el consumo de tabaco son factores que se deben tener en consideración.
Medidas de supervisión
En nuestro país no existe un programa de escrutinio para este tipo de cáncer, por lo que las consideraciones que se deben tomar para crearlo son definir los grupos de riesgo, determinar los estudios menos invasivos, seguimiento eficiente del programa y un tratamiento eficaz para los tumores temprano.
Sin duda, la panendoscopia, pese a ser un estudio invasivo, puede proporcionar información valiosa en el paciente de alto riesgo para detectar un tumor temprano o lesiones premalignas como es el esófago de Barrett donde, en este grupo de pacientes, hay que poner importante cuidado en la detección y seguimiento porque se trata de una lesión premaligna de alto riesgo.
Histopatología
El carcinoma epidermoide se localiza con mayor frecuencia en el tercio medio y superior del esófago. Son lesiones que infiltran y ulceran rápidamente para invadir la lámina propia y que utilizando la tinción de Lugol nos permite una mejor identificación de la lesión por endoscopía, así también, son tumores que rápidamente pueden formar conglomerados ganglionares intratorácicos. La enfermedad metastásica más frecuente se encuentra en hígado, hueso y pulmón.
En un alto porcentaje, el adenocarcinoma se desarrolla a partir del esófago de Barrett, una entidad patológica donde el epitelio escamoso normal es reemplazado por metaplásico columnar y glandular que progresa a displasia de grados bajo y alto. Biomarcadores como aneuploidía y pérdida de la heterogeneidad en el p53 incrementan el riesgo de progresión. Este tumor se localiza principalmente en el tercio distal del esófago y UEG en forma de lesiones nodulares o ulceradas que alteran el patrón vascular de la mucosa. La infiltración temprana incrementa el riesgo de diseminación ganglionar, principalmente en las estaciones abdominales. Se ha informado que el marcador HER2 es positivo en 30% y traduce mayor afección ganglionar, pero con posibilidad de incrementar respuesta al tratamiento con inmunoterapia.
En 2017, se publicó la clasificación molecular que claramente diferencia tumores epidermoides (con mutaciones encontradas en tumores de cavidad oral) de adenocarcinoma donde el perfil genómico es similar al del cáncer gástrico. Sin embargo, en ambas predomina la mutación en el p53.
Actualmente, en tumores avanzados, irresecables o metastásicos se deben solicitar pruebas moleculares para HER2, inestabilidad microsatelital, PD-L1 y genes de fusión NTRK que pueden dirigir o modificar el tratamiento molecular.4
Presentación clínica
Hasta 10% de los pacientes puede encontrarse asintomático al momento del diagnóstico. Los tumores de presentación temprana se detectan en forma incidental o bajo un seguimiento por esófago de Barrett.
Sin importar la histología, cuando el tumor tiene localización intratorácica, el principal síntoma es la disfagia progresiva de sólidos a líquidos, que se presenta cuando el diámetro del lumen esofágico es menor a 13 mm o la obstrucción es mayor del 60%. Además de dicho síntoma, varios pacientes también refieren pérdida significativa de peso.
En la serie reportada en el INCan, los principales síntomas fueron disfagia a sólidos en el 75.5%, pérdida de peso en el 82.3% y la media del índice de masa corporal (IMC) fue de 23.8±4.6 (14.6-42.6).1 Es importante considerar diagnósticos diferenciales que generan disfagia como las obstrucciones no malignas, por ejemplo, anillos fibróticos, leiomiomas, trastornos de la motilidad esofágica, acalasia y esofagitis por diversas causas. Otros síntomas menos frecuentes son odinofagia, hipersalivación, regurgitación inmediata de alimento, ronquera o disfonía por invasión tumoral a nervios laríngeos recurrentes. Finalmente, los tumores de la UEG pueden asociarse con sangrado microscópico que puede progresar a melena o hematemesis que desencadena un síndrome anémico.
Estudios de extensión
Se deberá obtener una biometría hemática con perfil de hierro para evaluar si el paciente tiene anemia asociada con deficiencia de hierro, que puede estar presente por sangrado microscópico hasta sangrado franco por hematemesis o melena.
También se debe evaluar la función renal y hepática, por lo que se agregan pruebas de funcionamiento hepático y niveles de creatinina más perfil de lípidos.
La panendoscopia es el estudio de elección para observar características específicas del tumor como el tamaño, extensión (margen proximal y distal), erosión o ulceración, invasión a la UEG y grado de obstrucción. Se deberá llevar a cabo la toma de biopsias (más de 6 a 8 biopsias representativas de las zonas sospechosas) para confirmar el diagnóstico histológico.
El siguiente estudio complementario es la tomografía axial computada (TAC) de cuello, tórax y abdomen con contraste oral e intravenoso que evalúa principalmente la enfermedad regional y metastásica. Sin embargo, si hay disponibilidad es preferible realizar PET-CT con 18 FDG porque incrementa la sensibilidad para detectar lesiones metastásicas ocultas y evaluar la actividad metabólica ganglionar.
Igualmente, el PET-CT con 18 FDG permite evaluar la respuesta a la neoadyuvancia, lo cual es fundamental antes de proponer una cirugía para descartar progresión de la enfermedad, sobre todo a distancia. No obstante, está contraindicado para tumores con etapa temprana (Tis, T1a-b), a menos que se haya realizado una resección endoscópica que reporte un mayor grado de invasión, o en algunos tumores mucinosos con células en anillo de sello donde la captación del radiofármaco es muy débil, sobre todo cuando se sospecha carcinomatosis abdominal.
Se indica el ultrasonido endoscópico para estadificar la enfermedad locorregional con alta sensibilidad para evaluar el T (S: 81-92% y E: 94-97%), en especial los tumores T3-4, tomar biopsias de adenopatías periesofágicas sospechosas mayores de 1cm y, sobre todo, cuando hay sospecha de invasión a la vía respiratoria, pericardio y aorta, pero se contraindica en tumores obstructivos.
Finalmente, la laparoscopia diagnóstica se realiza en tumores localmente avanzados con histología adenocarcinoma del tercio distal esofágico y UEG, que tienen riesgo elevado de desarrollar carcinomatosis peritoneal.
Estadificación
El pronóstico se determina por la etapa de la enfermedad; de modo que la correcta estadificación es fundamental para seleccionar el mejor tratamiento, según la etapa clínica.
Los tumores en etapa temprana (T1a/b, N0, M0) son poco frecuentes en nuestro medio y la resección endoscópica es el tratamiento más frecuente. Para tumores más avanzados resecables hay un grupo pequeño de pacientes (T2N0M0) que podría ir a cirugía de inicio con buen control de la enfermedad, pero el resto de los pacientes se beneficiará del tratamiento multimodal que inicia con neoadyuvancia para complementar con cirugía radical. Para los tumores no resecables o metastásicos, el tratamiento sistémico con quimioterapia y/o radioterapia es fundamental.
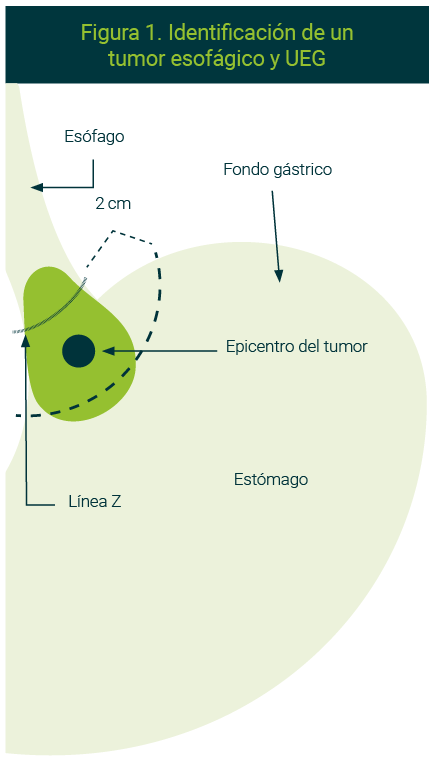
En el INCan utilizamos la clasificación de la AJCC (octava edición)5 para estadificar los tumores de esófago y de UEG (Figura 1). También aplicamos las nuevas recomendaciones para diferenciar entre un tumor del esófago vs. uno gástrico, por lo que tenemos que considerar lo siguiente:
- Tumores con epicentro localizado entre los primeros 2 cm del estómago, a partir de la línea Z y que infiltren la unión esófago-gástrica se clasificarán como un tumor de esófago.
- Tumores con epicentro localizado a más de 2 cm distales de la línea Z en el estómago y que infiltren la unión esófago-gástrica se clasificarán como tumor gástrico. Así también, el tumor con epicentro entre los primeros 2 cm del estómago a partir de línea Z, pero que no infiltre la unión esófago-gástrica, será considerado cáncer gástrico
Con esta clasificación observamos la importancia de identificar la línea Z por vía endoscópica. Ésta se encuentra en la zona donde terminan los vasos empalizados del esófago, sitio donde se hacen profundos para ingresar al estómago. Si el paciente tiene alterada la zona por esofagitis o esófago de Barrett, la segunda referencia endoscópica a identificar será donde terminen los pliegues gástricos y la unión esófago-gástrica será la zona entre los dos centímetros proximales y distales a la línea Z.
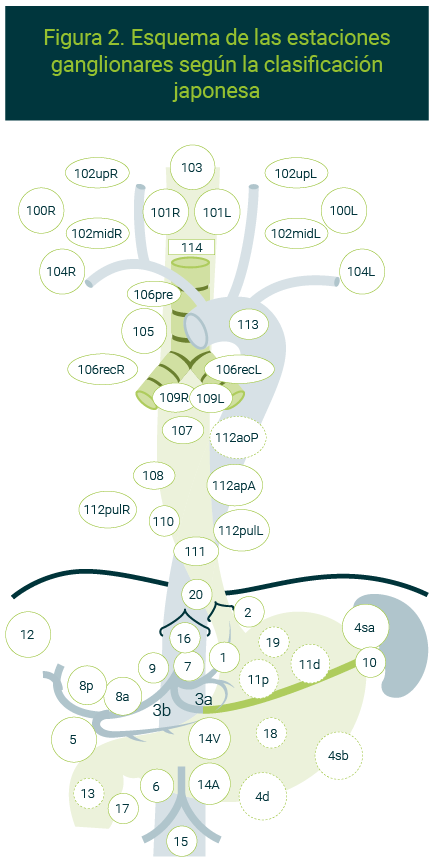
En relación con la clasificación ganglionar, en el INCan utilizamos la clasificación japonesa para tumores del esófago por ser más detallada para definir las estaciones cervicales, torácicas y abdominales6 (Tabla 1 y Figura 2):
| Tabla 1. Estaciones ganglionares para el cáncer de esófago6 | ||||
|---|---|---|---|---|
Cervicales | 100 | Ganglios superficiales del cuello | 103 | Ganglios perifaríngeos |
| 101 | Ganglios paraesofágicos cervicales | 104 | Ganglios supraclaviculares | |
| 102 | Ganglios cervicales profundos | |||
Torácicas | 105 | Ganglios paraesofágicos del tórax superior | 109L | Ganglios del bronquio principal izquierdo |
| 106recL | Ganglios paratraqueales del laríngeo recurrente izquierdo | 109R | Ganglios del bronquio principal derecho | |
| 106recR | Ganglios paratraqueales del laríngeo recurrente derecho | 110 | Ganglios paraesofágicos del tórax inferior | |
| 107 | Ganglios subcarinales | 111 | Ganglios supradiafragmáticos | |
| 108 | Ganglios paraesofágicos del tórax medio | 112 | Ganglios paraaórticos torácicos | |
Abdominales | 1 | Ganglios paracardiales derechos | 8ª | Ganglios de arteria hepática común antero-superior |
| 2 | Ganglios paracardiales izquierdos | 9 | Ganglios del tronco celíaco | |
| 3 | Ganglios de la curvatura menor | 10 | Ganglios del hilio esplénico | |
| 4SA | Ganglios gástricos cortos | 11 | Ganglios de arteria esplénica | |
| 4SB | Ganglios de vasos gastroepiplóicos izquierdos | 12 | Ganglios del ligamento hepatoduodenal | |
| 4D | Ganglios de vasos gastroepiplóicos derechos | 13 | Ganglios cara posterior cabeza de páncreas | |
| 5 | Ganglios suprapilóricos | 14 | Ganglios de vasos mesentéricos superiores | |
| 6 | Ganglios infrapilóricos | 15 | Ganglios de arteria cólica media | |
| 7 | Ganglios de arteria gástrica izquierda | 16 | Ganglios paraaórticos abdominales | |
La desnutrición se presenta hasta en el 75% de los pacientes con cáncer, sobre todo en tumores gastrointestinales donde el trastorno nutricional es frecuente en esófago debido a la disfagia progresiva como síntoma cardinal. Asimismo, al diagnóstico hay pérdida significativa de peso mayor al 10% en más del 70% de los pacientes, cuyo riesgo nutricional del 62.5% y desnutrición del 79%.7
El tamizaje de riesgo y evaluación nutricional periódica deben ser parte fundamental del tratamiento multimodal para identificar y optimizar a los pacientes en riesgo. Dicho tamizaje debe ser rápido y accesible, por lo que se utilizan herramientas simples y validadas. La ESPEN recomienda usar Nutrition Risk Screening 2002 (NRS-2002), Malnutrition Universal Screening Tool (MUST), Malnutrition Screening Tool (MST), Mini Nutritional Assessment Short Form Revised (MNA), que se aplicarán según la situación clínica del paciente. En los pacientes con detección anómala se deberá realizar una evaluación diagnóstica del origen y gravedad del trastorno nutricional y metabólico para dar el máximo beneficio a la intervención nutricional.8
Dentro de los objetivos de la terapia nutricional se encuentran mantener y mejorar la ingesta de alimentos, disminuir los trastornos metabólicos, preservar la masa músculo-esquelética con un buen rendimiento físico para reducir las interrupciones del tratamiento oncológico y mejorar la calidad de vida.
Dentro de las terapias para resolver la desnutrición en pacientes con cáncer tenemos el asesoramiento nutricional con o sin suplementos nutricionales orales (SNO), además de nutrición enteral y nutrición parenteral. Se recomienda adicionar SNO cuando la dieta enriquecida no alcanza los objetivos nutricionales; la nutrición artificial se indica en pacientes que no pueden tolerar la vía oral más de una semana o la ingesta calórica estimada es menor del 60% del requerimiento durante más de 1 a 2 semanas.9
Los requerimientos nutricionales o energéticos se determinan con precisión mediante el uso de calorimetría indirecta, pero en la práctica habitual, la disponibilidad es muy limitada y los requerimientos se estiman con fórmulas de predicción. En oncología se recomiendan de 25 a 30 kcal/kg/día más 1.2 a 2g de proteína/kg/día como aporte basal más un multivitamínico con oligoelementos.
En pacientes quirúrgicos, la respuesta metabólica al trauma induce una activación metabólica que genera cambios hormonales, hematológicos, metabólicos e inmunológicos.10
En pacientes oncológicos operados se debe instaurar el programa ERAS para minimizar el estrés quirúrgico, mantener estado nutricional, reducir complicaciones y acelerar la tasa de recuperación. Se debe evitar el ayuno prolongado, ajustar los líquidos intravenosos, usar carbohidratos de carga y tratar de reiniciar la vía oral lo antes posible para minimizar el índice de riesgo nutricional.11
La nutrición óptima no sólo es fuente de energía, también ayuda a la regeneración de tejidos, proliferación celular, cicatrización de heridas, mayor defensa del huésped contra infecciones; por lo que un aporte nutricional inadecuado o ausente provoca pérdida importante de tejido muscular, lo cual afecta la recuperación de los pacientes.
La cirugía de esófago es un procedimiento muy invasivo que genera un cambio anatómico permanente; por tanto, requiere una evaluación continua en el pre, peri y postoperatorio.
Dado que los pacientes pueden tener comprometido el estado nutricional antes de la cirugía, se recomienda la preparación nutricional durante 10 a 14 días antes de la intervención quirúrgica como parte de un programa de rehabilitación preoperatoria.
En el postoperatorio se busca iniciar tempranamente la nutrición enteral porque ha demostrado reducir el número de complicaciones mayores y la estancia hospitalaria, más que la nutrición parenteral.
La nutrición enteral se puede administrar mediante sonda o yeyunostomía. En nuestra institución, la nutrición enteral se inicia entre 24 a 48 horas después de la cirugía mediante sonda nasoyeyunal en pacientes con evolución posquirúrgica favorable. Se va progresando según la tolerancia del paciente, se inicia la ingesta de líquidos claros por boca hasta la papilla que se deja al egreso durante dos semanas posterior a éste.
El riesgo nutricional puede incrementar en los pacientes que están recibiendo quimioterapia, ya que al inicio tienen dificultades para deglutir los alimentos sólidos, no satisfacen las necesidades energético-proteicas y son pacientes en los que se debe iniciar la terapia nutricional personalizada, primero con suplementos orales y, posteriormente, con nutrición enteral o parenteral según el déficit y la tolerancia.
La condición clínica de los pacientes que reciben radioterapia puede complicarse con mucositis, que limita la ingesta oral e incrementa la pérdida de peso en más del 80%. En este grupo de pacientes se debe valorar la colocación de sonda para alimentación temporal que proporcione el aporte nutrición adecuado. La nutrición parenteral no está indicada como primera línea en pacientes bajo radioterapia, a menos que la vía enteral no esté disponible.
La inmunonutrición consiste en la administración de sustancias inmunomoduladoras como arginina, ácidos grasos omega 3 y antioxidantes que regulan o modulan el proceso inflamatorio e inmunológico después de una cirugía mayor. Hay reportes que indican que la implementación perioperatoria de la inmunonutrición reduce el riesgo de complicaciones infecciosas hasta 50%.12
Los pacientes con cáncer de esófago cursan con trastornos crónicos alimentarios que alteran la mucosa intestinal, por lo que el uso de inmunonutrición es beneficiosa para restaurar la integridad de la estructura y función celular de la mucosa. La suplementación oral con glutamina es una buena opción para estimular a los linfocitos y atenuar la permeabilidad intestinal. También se indica inmunonutrición en pacientes que están recibiendo quimio-radioterapia (QT/RT) para reducir la inflamación sistémica y mejorar el sistema inmunológico.13
Particularmente, los pacientes con esofagectomía pueden tener deficiencia de vitamina D (25-30%) con riesgo de desarrollar lesión pulmonar aguda (37.5%) y síndrome de dificultad respiratoria grave cuando hay niveles menores a 20nmol/l; de modo que se debe evaluar e indicar la suplementación de esta vitamina.14
Un equipo multidisciplinario debe elegir el mejor tratamiento oncológico de acuerdo con la histología y etapa clínica del tumor.
Tumores tempranos (Tis o T1a-b, N0, M0)
Son tumores limitados a la mucosa o submucosa, pero sin afección ganglionar. Tienen el mejor pronóstico, con un alto porcentaje de curación y las opciones de tratamiento son resección endoscópica o cirugía.
Los tumores T1a tienen riesgo menor del 5% de afección ganglionar contra los T1b donde el riesgo incrementa al 16%.15 Para indicar la resección endoscópica se debe considerar la apariencia del tumor (nodular, plano o ulcerado), tamaño menor a 2 cm, sin invasión linfovascular y de bajo grado de diferenciación. También se debe considerar ultrasonido endoscópico para evaluar la profundidad de invasión y tomar biopsia de los ganglios peritumorales. Es fundamental que un grupo con experiencia en resecciones endoscópicas lleve a cabo todo el tratamiento endoscópico para lograr el mejor control oncológico con baja tasa de complicaciones.
El tratamiento quirúrgico (o esofagectomía) en este grupo de pacientes se indica en tumores T1b, que tras resección endoscópica persiste con márgenes positivos, recurrencias no tratables por endoscopía o multifocalidad en un esófago de Barrett largo. Este tipo de cirugía se debe realizar en un centro de alto volumen (más de 20 esofagectomías por año) con experiencia para disminuir la morbimortalidad asociada con la cirugía, que puede ofrecer una alta tasa de curación en este grupo de pacientes, quienes deberán modificar el estilo de vida.
Tumores localmente avanzados (T1b, N+, M0 o T2-4b, N-/+, M0)
Para ofrecer el mejor tratamiento oncológico en este grupo de pacientes, se requiere un manejo multimodal que inicie el tratamiento neoadyuvante (quimioterapia o quimio-radioterapia) y, posteriormente, la cirugía radical. En todo momento se debe considerar el estado funcional del paciente y se debe evitar colocar prótesis para liberar obstrucciones en pacientes a quienes se dará un tratamiento con intento curativo porque el pronóstico puede empeorar.16
Los pacientes con cáncer de esófago y unión esófago-gástrica con enfermedad localmente avanzada (cT2N0M0 con factores de riesgo, cT3/T4a N0M0 y N1-3 M0, según la octava edición de la AJCC) son candidatos a tratamiento neoadyuvante o perioperatorio. Ambas modalidades de tratamiento han demostrado incrementar la tasa de resección de R0 y la SG; la elección de una u otra dependerá de las características clínicas de cada paciente, la localización anatómica y el subtipo histológico del tumor.17
TRATAMIENTO NEOADYUVANTE
Los beneficios teóricos de recibir quimioterapia, previa a la cirugía, son la reducción del volumen tumoral (downstaging), incremento de la probabilidad de lograr resección completa del tumor, eliminación de la enfermedad micrometastásica, disminución de síntomas y determinación de la sensibilidad del tumor a la quimioterapia.
El estudio MAGIC en pacientes con cáncer gástrico, UEG y esófago inferior localmente avanzado aleatorizó dos grupos: el primero con tres ciclos de ECF (epirrubicina, cisplatino y fluorouacilo), seguidos de cirugía y posteriormente tres ciclos adicionales de ECF versus sólo cirugía en el segundo grupo. El objetivo primario en SG sí demostró beneficio significativo a 5 años de 36% vs. 23%.
Posteriormente, el estudio fase III FLOT4-AIO comparó el esquema FLOT versus ECX perioperatorio con el objetivo primario de valorar SLE. Después de un ajuste, se decidió valorar SG y se encontró que a los 5 años mostraba beneficio significativo para el esquema FLOT vs. el MAGIC de 45% vs. 36% (HR 0.77, IC95% 0.63-0.94, p=0.012); además de beneficio en respuesta patológica completa (Becker TRG1a) de 16% vs. 6% (p=0.02).
Es importante señalar que 46% de los pacientes asignado a FLOT y 37% a MAGIC completaron los ciclos previstos en el protocolo y que las principales razones para descontinuar el tratamiento fueron complicaciones posoperatorias, efectos adversos asociados con quimioterapia y decisión del paciente.
Actualmente, con base en los resultados de este estudio, el esquema FLOT es el esquema de quimioterapia perioperatoria preferida
Se ha comentado que el tratamiento estándar en etapa temprana es la cirugía para los tumores menores de 3 cm, bien diferenciados. Sin embargo, con enfermedad localmente avanzada, el tratamiento deberá ser trimodal combinando QT/RT neoadyuvante, seguido de cirugía. El objetivo de este tratamiento es la reducción del volumen tumoral para incrementar la tasa de resección R0 (que incluya márgenes negativos) para lograr mayor control locorregional; no obstante, administrar únicamente radioterapia ha mostrado discreta mejoría para el control local.
El estudio CROSS estableció un nuevo paradigma para el tratamiento neoadyuvante total (TNT) con QT/RT seguida de cirugía. El estudio multicéntrico holandés, realizado entre 2004-2008, que incluyó pacientes menores de 75 años, ECOG <2, pérdida de peso <10%, etapa clínica cT1N1M0 o cT2-3N0-1M0 con histología epidermoide y adenocarcinoma, comparó dos grupos: QT/RT + cirugía vs. cirugía sola.
El grupo con QT/RT consistió en dar 5 ciclos semanales de carboplatino + paclitaxel + 41.4 Gy (23fx de 1.8Gy, 3D) con la finalidad de que después de 4 a 6 semanas se realizara esofagectomía transtorácica o transhiatal (tumores de la unión).
En el seguimiento a diez años, con una media de 147 meses, se observó que el tratamiento trimodal continua prolongando la SG (HR 0.70; 95% CI, 0.55- 0.89) con beneficio absoluto del 13% (38% vs. 25%) y reducción del riesgo de muerte (HR, 0.60; 95% CI, 0.46 a 0.80).
Las desventajas del estudio fueron que:
- sólo 16% fueron tumores del esófago superior o medio
- se excluyeron tumores T4, lo cual resulta insuficiente poder para detectar diferencias entre epidermoide y adenocarcinoma
- uso de técnicas de RT-3D que incrementan toxicidad cardiaca y pulmonar
- excluyó tumores mayores a 8 cm y los que habían perdido más del 10% de masa corporal
En este grupo de pacientes excluidos, una estrategia efectiva es iniciar con QT sola, y en el caso de respuesta, agregar la RT con el objetivo de disminuir el volumen tumoral. Este abordaje también puede considerarse en pacientes con tumores T4 o enfermedad ganglionar voluminosa N2 o mayor, con riesgo de progresión sistémica donde se debe intensificar el tratamiento sistémico.21
Es importante mencionar que la tasa de R0 es de 92% con esquema CROSS versus 69% sólo con cirugía (p<0.001), y que la respuesta patológica completa fue del 29% en el grupo CROSS con un perfil de toxicidad manejable.22-24
En el análisis por subtipo histológico se observó que, si bien los pacientes con carcinoma escamoso alcanzaron una SG más prolongada (46% a 10 años) y respuesta patológica completa (49%), en comparación con el subtipo adenocarcinoma (SG a 10 años de 26% y RPC de 23%), en ambos se observó el beneficio de agregar quimio-radioterapia neoadyuvante.
Además del esquema CROSS, otros esquemas de quimioterapia concomitante como PF (cisplatino) y FOLFOX han sido evaluados en ensayos fase II y fase III como parte del tratamiento con quimio-radioterapia neoadyuvante.
En general, el perfil de toxicidad y la dosis total de RT alcanzada para cada uno de estos esquemas es distinta y los resultados oncológicos han sido inconsistentes.25-27 Por lo tanto, la elección del esquema de quimioterapia concomitante deberá realizarse de forma individualizada, tomando como referencia el estudio CROSS que es el estudio fase III más grande y que ha demostrado los beneficios a largo plazo.
Se han intentado otras estrategias para aumentar la dosis de RT vía braquiterapia o boost. Un estudio fase II dio braquiterapia con Ir-192, se aplicaron 15 Gy, pero se observó incremento en la toxicidad (12% fístula y 24% toxicidad grado IV), además, hubo 10% de mortalidad relacionada con el tratamiento, por lo que se redujo la dosis a 10 Gy, pero pese a ello no hubo buenos resultados en supervivencia ni en control local. En el Hospital MD Anderson se ha utilizado boost simultáneo porque ha demostrado resultados favorables con 66% de control local a 2 años, con una toxicidad grado III del 23% y estenosis del 7%.28
El estudio POET aleatorizó 119 pacientes con tumores Siewert I-III, que recibieron esquema PF preoperatorio contra PF de inducción, seguido de quimio-radioterapia preoperatoria. Se observaron resultados favorables en el segundo grupo para SG (HR 0.65 (IC95% 0.42-1.01, p=0.055); sin embargo, los resultados no tuvieron significancia estadística y no es posible determinar cuál de las dos vías de tratamiento es la mejor.29
El estudio fase III NeoAEGIS para pacientes con adenocarcinoma que aleatorizó quimioterapia perioperatoria, con esquema MAGIC modificado o FLOT contra quimio-radioterapia neoadyuvante con esquema CROSS, tuvo como objetivo primario la SG.
Los resultados preliminares presentados en 2021 mostraron que los pacientes tratados con CROSS tuvieron mayor tasa de resección R0 y respuesta patológica completa vs. el grupo de sólo quimioterapia (95% vs. 82% y 16% vs. 5%), pero no se mostraron diferencias significativas en SG.30
Hasta este momento, no existen ensayos clínicos con resultados que comparen directamente FLOT contra CROSS en adenocarcinoma de esófago y UEG, por lo que el debate de cómo tratar a este grupo de pacientes continua y los resultados del estudio ESOPEC son esperados. En la Tabla 2 se resumen las principales características y resultados de los estudios CROSS y FLOT4-AIO.
| Tabla 2. Principales características y resultados de los estudios CROSS y FLOT4-AIO | |||||||
|---|---|---|---|---|---|---|---|
| Estudio | Población incluida | Grupos | Objetivo primario | SG | HR (IC 95%), p | R0 | RPC |
| CROSS23 Fase III n=366 | Cáncer de esófago y UEG escamoso y adenocarcinoma ECOG 0-1 | 5 ciclos carboplatino/paclitaxel + 41.4G y en 23 fracciones + cirugía vs. cirugía | SG | 49 meses SG-5 años: 47% SG-10 años: 38% | HR 0.70; IC 95%, 0.55-0.89, p=0.004 | 92% | 29% |
| FLOT420 Fase III n=716 | Cáncer de UEG y estómago adenocarcinoma ECOG 0-1 | FLOTx4 → cirugía → FLOTx4 vs. ECF/ECX x3 → cirugía → ECF/ECX x3 | SG | 50 meses SG-5 años 45% | HR 0.77; IC 95% 0.63-0.94, p=0.012 | 85% | 16% |
| SG: supervivencia global; RPC: respuesta patológica completa; FLOT: fluorouacilo, leucovorin, oxaliplatino y docetaxel; ECF: epirrubicina, cisplatino y fluorouacilo; ECX: epirrubicina, cisplatino y capecitabina; HR: hazard ratio; IC: intervalo de confianza | |||||||
No es estándar el uso de fármacos anti-HER, antiangiogénicos o IPC en el escenario pre o perioperatorio. Los IPC pudieran aportar una mayor tasa de respuesta patológica completa, pero no se ha demostrado que el uso de estas terapias tenga beneficios en supervivencia.31
La QT/RT definitiva se indica en pacientes que no pueden ser operados por alta morbilidad quirúrgica. Los mejores candidatos son los que tienen tumores localizados en el esófago cervical (≤5 cm de músculo cricofaríngeo) y los que rechazan el tratamiento quirúrgico.
La dosis total de radioterapia a considerar en este escenario es de 50.4 Gy; y puede emplearse FOLFOX, PF o carboplatino + paclitaxel como esquemas de concomitancia. En el estudio fase III PRODIGE5/ACCORD17, pacientes con cáncer de esófago, de cualquier histología, irresecables o inoperables, fueron aleatorizados para recibir quimio-radioterapia definitiva con seis ciclos de FOLFOX o cuatro ciclos de PF.
El objetivo primario fue la SLP. No hubo diferencias significativas en SLP (9.7 vs. 9.4 meses), SG (20.2 vs. 17.5 meses), tiempo de falla a tratamiento (TFT) (8.0 vs. 8.3 meses) o respuesta endoscópica completa (REC) (53% vs. 48%) entre ambos regímenes de tratamiento.32
El estudio fase III ARTDECO33 evaluó el efecto de escalamiento de dosis en progresión local que estaban recibiendo QT/RT definitiva, no operables o no resecables, etapa T1-4N0-3, M0 o M1. El grupo estándar con 50.4 Gy (3+1 cm CTV para PTV, con IGRT >1/sem) vs. 61.6 Gy (fx 2.2 Gy) con IMRT concomitante con CBP + paclitaxel. Se incluyeron 260 pacientes (epidermoide 62% y adenocarcinoma 38%). La radioterapia se completó en el 96% del grupo estándar vs. 92% dosis alta. En el seguimiento a 50 meses no se observaron diferencias para supervivencia a 3 años (70% vs. 73%), ni para la histología epidermoide (75% vs. 79%), adenocarcinoma (61% vs. 61%); tampoco hubo diferencias para la toxicidad G4 (12% vs. 5%) ni G5 (14% vs. 10%).
El tratamiento quirúrgico complementa la respuesta obtenida en la neoadyuvancia para ofrecer el mejor control locorregional de la enfermedad.
Se debe considerar la histología, localización del tumor, etapa clínica, respuesta a tratamiento, estado funcional, comorbilidades y deseo del paciente. Se requiere evaluación completa preoperatoria que incluya la rehabilitación pulmonar, corrección del estado nutricional, suspender tabaco y alcohol, valoración psicológica y control de comorbilidades con el objetivo de reducir las complicaciones asociadas con el procedimiento quirúrgico. Esta preparación prequirúrgica se debe instaurar al menos tres semanas antes de la cirugía.
La radicalidad de la cirugía debe considerar la resección completa del tumor con márgenes microscópicos negativos (proximal, distal y circunferencial), disección ganglionar completa acorde con la histología y localización tumoral, además de una reconstrucción baja en tasa de complicaciones.
La decisión de realizar un abordaje transhiatal o transtorácico afecta la calidad de la disección ganglionar de las estaciones intratorácicas. La toma de decisión dependerá de la histología, epicentro de la lesión, extensión proximal del tumor a partir de la línea Z, antes de aplicar el tratamiento neoadyuvante que, pese a tener una respuesta completa, el abordaje quirúrgico (que se ha decidido previamente) no se modifica, a menos que el estado funcional este comprometido.
El margen proximal recomendado es de 5 cm y distal de 2 cm, pero se requiere de un estudio por corte congelado en el transoperatorio para confirmar que estos sean negativos. Para lograr tener un margen circunferencial negativo (> 1mm microscópico), se debe realizar una resección en bloque entre la vena ácigos y el pericardio (mesoesófago) que deberá incluir todo el contenido entre las pleuras mediastinales, junto con el conducto torácico.
Los diferentes tipos de esofagectomía dependerán de la localización del tumor; los más frecuentes son Ivor-Lewis, que consta de dos incisiones (una abdominal y otra torácica derecha) con anastomosis intratorácica para tumores del tercio distal del esófago con invasión intratorácica infracarinal.
La esofagectomía McKeown consiste en tres incisiones (abdominal, torácica y cervical) para tumores del tercio medio y superior del esófago, con anastomosis cervical que permita hacer una linfadenectomía completa torácica y cervical que con mayor frecuencia se realiza en tumores epidermoides o adenocarcinoma con invasión extensa del esófago intratorácico.
Finalmente, la esofagectomía transhiatal (Orringer) consiste en dos incisiones (abdominal y cervical) con el objetivo de no ingresar al tórax y realizar la disección del esófago a través del hiato con una anastomosis cervical. Se indica para tumores de la unión esófago-gástrica que no invadan más de 2 cm por encima de la línea Z. Algunos autores consideran que este abordaje no ofrece una correcta radicalidad por la disección ganglionar limitada, por lo que la reservan para pacientes con compromiso respiratorio, edad avanzada o tumores tempranos Tis o T1a-b.
Respecto a la disección ganglionar, los tumores T1b tienen un riesgo entre 20-40% de invasión ganglionar; en consecuencia, requieren cirugía radical que incluya una buena disección ganglionar. Nuestra población tiene una tendencia a mayor incidencia del adenocarcinoma, por lo que usamos las definiciones de la escuela europea para la disección ganglionar:
- Disección estándar de dos campos. Linfadenectomía del mediastino desde el diafragma hasta los ganglios subcarinales y la ventana aorto-pulmonar (niveles 107, 108, 109, 110, 111, 112). En abdomen, se disecan ganglios del tronco celíaco, hepática común, arteria esplénica, curvatura menor gástrica tercio proximal- medio y curvatura mayor proximal (niveles 1, 2, 3, 4sa ,4sb, 7,8a, 9,11).
- Disección extendida de dos campos. Es la disección estándar más los ganglios paratraqueales inferiores del lado derecho (nivel 106R), pero no los superiores (nivel 104R).
- Disección total de dos campos. Es la disección extendida más los ganglios paratraqueales del lado izquierdo, donde se localiza el nervio laríngeo recurrente izquierdo (nivel 106 L). Esta disección es la indicada para tumores epidermoides, ya que se localizan con frecuencia en el tercio medio del esófago, con alto riesgo de diseminarse a todas las estaciones ganglionares torácicas.
No hay un estudio prospectivo que compare las disecciones entre ellas, pero se ha determinado que tumores de UEG o esófago distal pueden ser llevados a disección ganglionar estándar con anastomosis intratorácica, en contraste con tumores del tercio medio o proximal intratorácico que requieren al menos una disección extendida más anastomosis cervical para mejorar el control locorregional.
Un metanálisis reciente demostró que la disección de tres campos prolonga la supervivencia en la histología escamosa en los tumores del tercio medio y proximal que son comunes en la población asiática.34
Otro concepto importante que aborda la calidad en la disección es la cosecha ganglionar, donde al menos se requieren 15 ganglios para poder estadificar según la AJCC. Sin embargo, estudios retrospectivos mostraron que entre más extensa sea la disección, se asocia con mayor supervivencia; un estudio recomendó cosechar al menos 23 ganglios para incidir en supervivencia.35
Recientemente, un estudio en pacientes que recibieron tratamiento neoadyuvante y posteriormente fueron sometidos a cirugía demostró que la cosecha ganglionar óptima debe ser de 25 ganglios para mejorar la estadificación e incidir en supervivencia, sin importar la respuesta al tratamiento neoadyuvante.36 Con esta evidencia podemos observar que la cirugía radical si impacta en la supervivencia posterior a la neoadyuvancia.
Actualmente, la controversia se encuentra entre dos grupos. Uno de ellos está a favor de la disección extensa que mejora la estadificación patológica ganglionar e incrementa el control locorregional y pronóstico del paciente. El otro considera que la biología tumoral más la etapa clínica son más importantes y que la aparente mejoría en el pronóstico por la disección extensa es consecuencia del efecto de migración por etapa, pero no hay beneficio real en supervivencia.
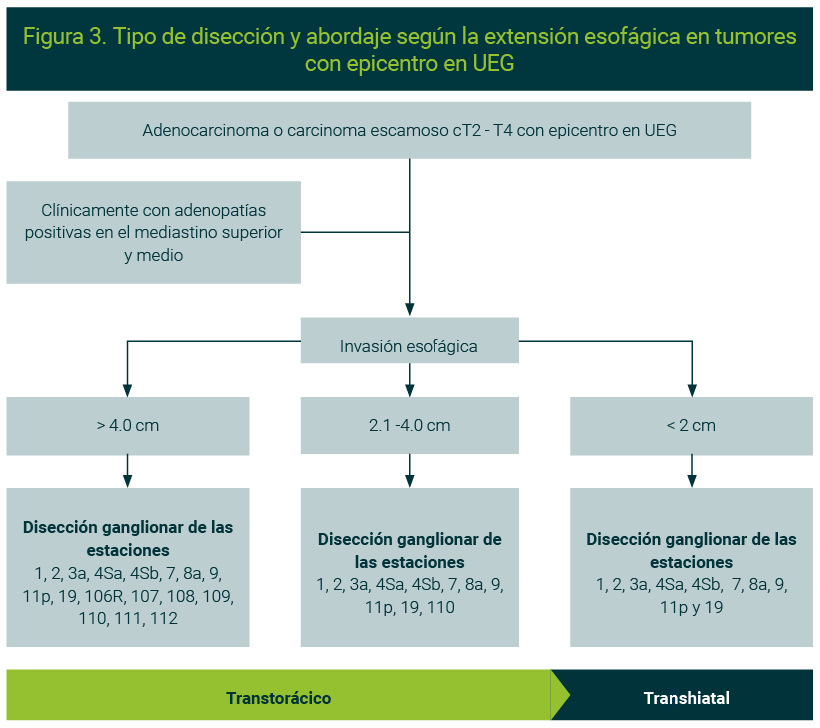
Recientemente, el Dr. Kitagawa publicó un estudio para tumores localmente avanzados con epicentro en UEG en el que mide detalladamente el grado de invasión esofágica y señala que se puede predecir el tipo de disección y sugerir el mejor abordaje antes del iniciar el tratamiento neoadyuvante (Figura 3).37
Para reconstruir, en más del 95% se usa el tubo gástrico por ser órgano contiguo, bien vascularizado y se deben preservan los vasos gastroepiplóicos derechos, que son suficientes para mantener la viabilidad de un tubo entre 3 a 3.5 cm de diámetro.
El cirujano será quien decidirá realizar piloromiotomía, ya que no hay estudios que comparen realizarla o no. Si bien este procedimiento puede mejorar el vaciamiento gástrico, también incrementa el dumping o reflujo biliar.
La cirugía de esófago es una de las más complejas del tubo digestivo. En centros de alto volumen, la morbilidad general es del 59% con una morbilidad mayor del 28.5% y mortalidad entre 2 a 4%. Las principales complicaciones son fuga de anastomosis (11.1%), necrosis del tubo gástrico (1.2%), lesión de laríngeos recurrentes (4%) y fuga quilosa (4.7%).38
En la última década, la esofagectomía por mínima invasión ha mostrado mejores resultados postquirúrgicos contra el abordaje abierto porque no compromete el control oncológico en el paciente bien seleccionado y ha logrado disminuir el porcentaje de complicaciones pulmonares hasta un 77% en centros con experiencia.
El estudio TIME es el primer estudio prospectivo y aleatorio que comparó el abordaje abierto con mínima invasión y mostró menos complicaciones pulmonares, mejor calidad de vida posterior a seis semanas, sin inferioridad para el control oncológico y sin diferencias para supervivencia a largo plazo.39
En Asia y Europa, el abordaje toracoscópico en posición prono ya es de elección porque no requiere ventilación selectiva y mantiene buena tasa de ventilación/perfusión transoperatoria, que disminuye complicaciones pulmonares; el campo operatorio por efecto de gravedad es más limpio y el equipo quirúrgico está en una posición cómoda.
En nuestra institución, recientemente presentamos nuestra experiencia inicial con este abordaje en 25 pacientes con una media de 57 años de edad con predominio del género masculino (84%) y de la histología adenocarcinoma intestinal (76%). De estos pacientes, 96% fueron tumores localmente avanzados a los que se dio tratamiento neoadyuvante.
Los resultados quirúrgicos no muestran conversión en el tiempo torácico y 24% se convirtió en el tiempo abdominal, la media de sangrado fue de 243 ml (50-800) con una estancia hospitalaria de 12 días. En el 96% de los pacientes, la disección ganglionar fue extendida y la tasa de complicaciones mayores (Clavien > 3) fue del 12%; sólo un paciente falleció por complicación cardiaca en los primeros 30 días postquirúrgicos. La cosecha ganglionar media fue de 37.8 (12-66) ganglios. El seguimiento medio fue de 32.1 meses y la supervivencia cáncer específico a 3 años fue del 76%, pero aún queda pendiente reportar los resultados oncológicos a 5 años de seguimiento.40
TRATAMIENTO ADYUVANTE
La adyuvancia con QT/RT se recomienda en pacientes con un tumor patológico mayor a T3 y con márgenes positivos o estaciones ganglionares positivas, siempre que hayan recibido sólo QT perioperatoria con el objetivo de disminuir el riesgo de recurrencia locorregional. Sin embargo, la eficacia puede disminuir por un lecho tumoral hipóxico y la dosis de RT se limita para evitar complicaciones en la anastomosis quirúrgica.
Respecto a la adyuvancia con nivolumab, aprobada por la Food and Drug Administration (FDA) en estos pacientes con tumor residual posterior a recibir QT/RT neoadyuvante, el estudio que logró la aprobación de nivolumab adyuvante fue CheckMate-577. Este estudio fase III incluyó pacientes con cáncer de esófago y UEG de subtipo adenocarcinoma y escamoso; recibieron quimio-radioterapia preoperatoria y al momento de la resección documentaron enfermedad residual. Los pacientes fueron aleatorizados 2:1 a recibir hasta 1 año de nivolumab adyuvante o placebo.
Con el objetivo primario de la supervivencia libre de enfermedad, nivolumab demostró mejoría significativa de 22.4 contra 11.0 meses con un perfil de toxicidad aceptable. Este beneficio se mantuvo independientemente del subtipo histológico y de la expresión de PD-L1, aunque en un análisis post hoc, el beneficio fue mayor en CPS ≥5.
Los resultados a largo plazo del estudio CheckMate-577 aún no se publican, pero el objetivo primario respecto a la supervivencia libre de enfermedad se cumplió y será interesante saber si tendrá efecto en la SG.41
QUIMIOTERAPIA Y RADIOTERAPIA PALIATIVA
En el terreno paliativo para tumores avanzados, el uso de RT se indica para tumores obstructivos en pacientes con disfagia o con sangrado activo, sobre todo cuando no se controla por endoscopía y, de lograr disminuir el sangrado con RT, mejora la calidad de vida.
El uso de protones tiene beneficios dosimétricos y efectividad biológica, pero no ha demostrado beneficio al comparase con los fotones. Finalmente, pareciera que pacientes obstructivos tienen mejor calidad si se les coloca stent metálico auto expandible vs. recibir radioterapia; por lo que queda reservada en pacientes que no se pueden llevar al procedimiento endoscópico.
TRATAMIENTO PARA LA ENFERMEDAD METASTÁSICA
La biología tumoral y el pronóstico de la etapa avanzada dependen del subtipo histológico, la expresión de biomarcadores y la localización geográfica. Entonces, la elección del tratamiento en este escenario estribará en el estado funcional del paciente y los factores previamente mencionados.
En esta etapa, los cuidados de soporte médico y la inclusión a ensayos clínicos siempre son opciones de tratamiento que se deberán tener presentes. Es fundamental indicar tratamientos paliativos, elegir adecuadamente a los pacientes porque a varios de ellos se les puede colocar un stent vía endoscópica para mejorar el proceso obstructivo y mantener la ingesta por vía oral, misma que se ha deteriorado progresivamente y empeora la calidad de vida.
En el último de los escenarios, cuando no es posible colocar el stent y el estado funcional del paciente lo permite, se puede realizar una gastrostomía quirúrgica para mantener una vía de alimentación enteral.
Ante enfermedad metastásica, se debe solicitar determinación de PD-L1 por puntuación positiva combinada (CPS) mediante inmunohistoquímica, MSI mediante PCR o NGS (o bien, MMR mediante inmunohistoquímica), TMB por NGS y HER2 por inmunohistoquímica ± FISH/ISH. Estudios recientes han demostrado que la eficacia de la inmunoterapia, en combinación con quimioterapia; actualmente es el régimen preferido (Tabla 3).
| Tabla 3. Principales ensayos fase III en tratamiento de cáncer de esófago metastásico, primera línea | |||||||
|---|---|---|---|---|---|---|---|
| Estudio | Localización anatómica e histología | Geografía | Biomarcador | Brazos | Objetivo primario | Supervivencia global | Porcentaje de respuesta |
CheckMate-64842 | Esófago escamoso | 70% Asia 30% no-Asia | PD-L1 TPS ≥1 28-8 pharmDx | Nivolumab + PF vs. Nivolumab + ipilimumab vs. PF | SG y SLP PD-L1 TPS ≥1 | 15.4 meses HR 0.54, p<0.001 vs. 13.7 meses HR 0.64, p=0.001 vs. 9.1 meses | 53% vs. 35% vs. 20% |
CheckMate-64943 | Esófago 12% UEG 18% Gástrico 70% Adecocarcinoma | 17% EUA y Canadá 22% Asia | PD-L1 CPS ≥1 PD-L1 CPS ≥5 28-8 pharmDx | Nivolumab + ipilimumab vs. Nivolumab + FOLFOX/CAPOX vs. FOLFOX/CAPOX | SG y SLP PD-L1 CPS ≥5 | 14.4 meses HR 0.71, p<0.0001 vs. 11.2 meses HR 0.89, p=0.2302 vs. 11.1 meses | CPS ≥5 Nivolumab + QT vs. QT 60% vs. 45% nivolumab + ipilimumab vs. QT 27% vs. 47% |
KeyNote-59044 | Esófago y UEG escamoso 73% Adenocarcinoma | 53% Asia 47% no-Asia | PD-L1 CPS ≥10 23C3 pharmDx | Pembrolizumab + PF vs. pembrolizumab | SG y SLP AIT | 12.4 meses HR 0.73, p<0.0001 vs. 9.8 meses | 45% vs. 29.3% |
ESCORT-1st 45 | Esófago escamoso | China | ND | Camrelizumab + TP vs. placebo + TP | SG y SLP AIT | 15.3 meses HR 0.62, p<0.0001 vs. 12.0 meses | 72.1% vs. 62.1% |
ORIENT-1546 | Esófago escamoso | China | PD-L1 CPS ≥10 23C3 pharmDx | Sintilimab + TP vs. placebo + TP | SG y SLP IAIT y CPS ≥10 | ITT 16.7 vs. 12.5 meses HR 0.628, p<0.0001 CPS ≥10 17.2 vs. 13.6 meses HR 0.638, p<0.0018 | AIT 66.1% vs. 45.4% |
ORIENT-1647 | UEG y gástrico Adenocarcinoma | China | PD-L1 CPS ≥5 23C3 pharmDx | Sintilimab + TP vs. placebo + TP | SG AIT y CPS ≥5 | ITT 15.2 vs. 12.3 meses HR 0.766, p=0.0090 CPS ≥5 18.4 meses vs. 12.9 meses HR 0.660, p=0.0023 | AIT 58.2% vs. 48.8% |
JUPITER-0648 | Esófago escamoso | China | PD-L1 CPS ≥1 23c3 pharmDx | Toripalimab + TP vs. placebo + TP | SG y SLP AIT | 17.0 meses HR 0.58, p=0.00036 vs. 11.0 meses | 69.3% vs. 52.1% |
| SG: supervivencia global; SLP: supervivencia libre de progresión; CPS: puntuación positiva combinada; ND: no disponible; PF: cisplatino + 5FU; TP: cisplatino + paclitaxel; QT: quimioterapia; AIT: análisis por intención a tratar | |||||||
El PD-L1 es el biomarcador predictivo de respuesta más utilizado en ensayos de primera línea. Para determinarlo se han utilizado diferentes anticuerpos, sistemas de puntuación y umbrales de positividad, lo cual dificulta contextualizar los resultados disponibles.
La CPS se ha posicionado como el sistema de puntuación preferido; no obstante, los estudios con pembrolizumab suelen utilizar umbrales de positividad CPS ≥1 o ≥10; mientras que los estudios con nivolumab suelen emplear CPS ≥5.
La heterogeneidad tumoral espacial y temporal complica aún más la evaluación de PD-L1, ya que podrían requerirse más de una biopsia y muestras repetidas en el transcurso de la progresión de la enfermedad; tampoco se ha establecido si se prefiere biopsia del sitio primario o de las lesiones metastásicas. Lo anterior demuestra que PD-L1 es un biomarcador imperfecto y también subraya la necesidad de optimizar y homogeneizar los procesos de determinación en el futuro.49
Se recomienda trastuzumab + quimioterapia como terapia de primera línea para pacientes con adenocarcinoma con sobrexpresión de HER2.
Ramucirumab, como agente único o en combinación con paclitaxel (preferido) y pembrolizumab (para tumores MSI-H/dMMR o TMB-H) se incluyen como opciones para la terapia de segunda línea o posterior. Nivolumab se incluye como una opción de segunda línea preferida para el subtipo escamoso. Pembrolizumab también se ha incluido como una opción de segunda línea para subtipo escamoso con CPS de ≥10. Dostarlimab-gxly es una alternativa a pembrolizumab para tumores MSI-H/dMMR.
El mayor porcentaje de recurrencia se presenta en los primeros dos años. Por tanto, varios de estos pacientes se pueden beneficiar de una nueva resección endoscópica en caso de tumores tempranos o cirugía de salvamento en aquéllos que recibieron tratamiento con QT/RT definitiva.
Esta vigilancia se centra en valorar síntomas, estado nutricional y apoyo psicológico, por lo que debe permanecer el equipo multidisciplinario durante el seguimiento, sobre todo en los pacientes en que se realizó una esofagectomía, donde cambia el estilo de vida, la forma de comer y hay más problemas asociados con la pérdida de peso a los que se debe estar atento.
Se debe evaluar al paciente cada tres meses mediante un interrogatorio minucioso, exploración física completa más laboratorios generales de sangre y complementar en forma alterna la realización de la panendoscopia y tomografía computada.
Esta oncoguía para tumores de esófago y unión esófago-gástrica tiene muestra el panorama actual epidemiológico de esta patología, diferencia las dos histologías más frecuentes con todas las características clínicas de presentación más el abordaje diagnóstico apropiado, sin olvidar los aspectos nutricionales para, finalmente, estadificar y ofrecer las opciones actuales de tratamiento que se realizan en el INCan, según la etapa clínica.
Sirvan las siguientes líneas como ideas clave de todo el documento:
- El cáncer de esófago y unión esófago-gástrica tiene una alta letalidad y se ubica entre los diez principales tumores a nivel mundial, en el INCan predomina la histología adenocarcinoma, seguida por el carcinoma epidermoide y la presentación más frecuente es la etapa localmente avanzada y metastásica.
- Se debe tener alto índice de sospecha en pacientes con disfagia progresiva y pérdida de peso que son los síntomas principales. El abordaje multidisciplinario es lo más apropiado para la toma de decisiones en cada paciente.
- Identificar la línea Z por endoscopía es fundamental para ubicar el epicentro del tumor y clasificarlo como un tumor de esófago, unión esófago-gástrica o gástrico, con lo cual se logra dar el tratamiento mas apropiado.
- El tratamiento multimodal (quimioterapia, radioterapia y cirugía) es el que ofrece el mejor control oncológico en la etapa localmente avanzada. Para la etapa avanzada, la quimioterapia y/o inmunoterapia son los tratamientos de elección.
- La esofagectomía radical transtorácica en posición prono es el tratamiento quirúrgico que otorga el mejor control locorregional oncológico por la disección ganglionar extensa, pero se debe realizar en centros de alto volumen con experiencia para tener una baja tasa de morbimortalidad.
| 1. | Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2021;71(3):209-49. |
| 2. | Codipilly DC, Sawas T, Dhaliwal L, Johnson ML, Lansing R, Wang KK, et al. Epidemiology and outcomes of young-onset esophageal adenocarcinoma: An analysis from a population-based database. Cancer Epidemiol Biomarkers Prev. 2021; 30(1):142-49. |
| 3. | Leon Takahashi AM, Lopez Basave HN, Lino Silva LS, Calderillo Ruiz G, Ruiz Garcia EB, Diaz Romero MC, et al. 538. A decade of esophageal and esophago-gastric junction cancer epidemiology in National Cancer Intitute Mexico. Dis Esophagus. 2022;35(Suppl 2):111-112. Available from URL: https://academic.oup.com/dote/article/35/Supplement_2/doac051.538/6711827 |
| 4. | Smyth EC, Lagergren J, Fitzgerald RC, Lordick F, Shah MA, Lagergren P, et al. Oesophageal cancer. Nat Rev Dis Primers. 2017;3:17048. |
| 5. | Rice TW, Kelsen DP, Blackstone EH, Ishwaran H, Patil DT, Bass AJ, et al. Esophagus and esophagogastric junction. In: Amin MB, Edge SB, Greene FL, Byrd DR, Brookland RK, Washington MK, et al., editors. AJCC Cancer Staging Manual, 8th ed. New York: Springer, 2017:185-202. |
| 6. | Japan Esophageal Society. Japanese classification of esophageal cancer, 11th edition: part I. Esophagus. 2017;14(1):1-36. |
| 7. | Jordan T, Mastnak DM, Palamar N, Kozjek NR. Nutritional therapy for patients with esophageal cancer. Nutr Cancer.2018;70(1):23-29. |
| 8. | Arends J, Bachmann P, Baracos V, Barthelemy N, Bertz H, Bozzetti F, et al. ESPEN guidelines on nutrition in cancer patients. Clin Nutr. 2017;36(1):11-48. |
| 9. | Steenhagen E, van Vulpen JK, van Hillegersberg R, May AM, Siersema PD. Nutrition in peri-operative esophageal cancer management. Expert Rev Gastroenterol Hepatol. 2017;11(7):663-72. |
| 10. | Fukatsu K. Role of nutrition in gastroenterological surgery. Ann Gastroenterol Surg. 2019;3(2):160-68. |
| 11. | Gustafsson UO, Scott MJ, Schwenk W, Demartines N, Roulin D, Francis N, et al. Guidelines for perioperative care in elective colonic surgery: Enhanced Recovery After Surgery (ERAS®) Society recommendations. Clin Nutr. 2012;31(6):783-800. |
| 12. | Stratton RJ, Elia M. Who benefits from nutritional support: What is the evidence? Eur J Gastroenterol Hepatol. 2007;19(5):353-8. |
| 13. | Ma C, Tsai H, Su W, Sun L, Shih Y, Wang J. Combination of arginine, glutamine, and omega-3 fatty acid supplements for perioperative enteral nutrition in surgical patients with gastric adenocarcinoma or gastrointestinal stromal tumor (GIST): A prospective, randomized, double-blind study. J Postgrad Med. 2018;64(3):155-63. |
| 14. | Mimatsu K, Fukino N, Ogasawara Y, Saino Y, Oida T. Effects of enteral immunonutrition in esophageal cancer. Gastrointest Tumors. 2018;4(3-4):61-71. |
| 15. | Merkow RP, Bilimoria KY, Keswani RN, Chung J, Sherman KL, Knab LM, et al. Treatment trends, risk of lymph node metastasis, and outcomes for localized esophageal cancer. J Natl Cancer Inst. 2014;106(7):dju133. |
| 16. | Mariette C, Gronnier C, Duhamel A, Mabrut JY, Bail JP, Carrere N, et al. Self-expanding covered metallic stent as a bridge to surgery in esophageal cancer: Impact on oncologic outcomes. J Am Coll Surg. 2015;220(3):287-96. |
| 17. | Obermannová R, Alsina M, Cervantes A, Leong T, Lordick F, Nilsson M, et al. Oesophageal cancer: ESMO clinical practice guideline for diagnosis, treatment and follow-up. Ann Oncol. 2022;33(10):992-1004. |
| 18. | Cunningham D, Allum WH, Stenning SP, Thompson JN, van de Velde CJH, Nicolson M, et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med. 2006;355(1):11-20. |
| 19. | Al-Batran SE, Hofheinz RD, Pauligk C, Kopp HG, Haag GM, Luley KB, et al. Histopathological regression after neoadjuvant docetaxel, oxaliplatin, fluorouracil, and leucovorin versus epirubicin, cisplatin, and fluorouracil or capecitabine in patients with resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4-AIO): Results from the phase 2 part of a multicentre, open-label, randomized phase 2/3 trial. Lancet Oncol. 2016;17(12):1697-708. |
| 20. | Al-Batran SE, Homann N, Pauligk C, Goetze TO, Meiler J, Kasper S, et al. Perioperative chemotherapy with fluorouracil plus leucovorin, oxaliplatin, and docetaxel versus fluorouracil or capecitabine plus cisplatin and epirubicin for locally advanced, resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4): A randomised, phase 2/3 trial. Lancet. 2019;393(10184):1948-57. |
| 21. | Eyck BM, van Lanschot JJB, Hulshof MCCM, van der Wilk BJ, Shapiro J, van Hagen P, et al. Ten-year outcome of neoadjuvant chemoradiotherapy plus surgery for esophageal cancer: The randomized controlled CROSS Trial. J Clin Oncol. 2021;39(18):1995-2004. |
| 22. | van Hagen P, Hulshof MCCM, van Lanschot JJB, Steyerberg EW, van Berge Henegouwen MI, Wijnhoven BP, et al. Preoperative chemoradiotherapy for esophageal or junctional cancer. N Engl J Med. 2012;366(22):2074-84. |
| 23. | Shapiro J, van Lanschot JJB, Hulshof MCCM, van Hagen P, van Berge Henegouwen MI, Wijnhoven BPL, et al. Neoadjuvant chemoradiotherapy plus surgery versus surgery alone for oesophageal or junctional cancer (CROSS): Long-term results of a randomised controlled trial. Lancet Oncol. 2015;16(9):1090-8. |
| 24. | Leichman LP, Goldman BH, Bohanes PO, Lenz HJ, Thomas CR, Billingsley KG, et al. S0356: A Phase II clinical and prospective molecular trial with oxaliplatin, fluorouraand external-beam radiation therapy before J Clin Oncol. 2011;29(34):4555-60. |
| 25. | Tepper J, Krasna MJ, Niedzwiecki D, Hollis D, Reed CE, Goldberg R, et al. Phase III trial of trimodality therapy with cisplatin, fluorouracil, radiotherapy, and surgery compared with surgery alone for esophageal cancer: CALGB 9781. J Clin Oncol. 2008;26(7):1086-92. |
| 26. | Mariette C, Dahan L, Mornex F, Maillard E, Thomas PA, Meunier B, et al. Surgery alone versus chemoradiotherapy followed by surgery for stage I and II esophageal cancer: Final analysis of randomized controlled phase III trial FFCD 9901. J Clin Oncol. 2014;32(23):2416-22. |
| 27. | Conroy T, Yataghène Y, Etienne PL, Michel P, Senellart H, Raoul JL, et al. Phase II randomised trial of chemoradiotherapy with FOLFOX4 or cisplatin plus fluorouracil in oesophageal cancer. Br J Cancer. 2010;103(9):1349-55. |
| 28. | Cummings D, Wong J, Palm R, Hoffe S, Almhanna K, Vignesh S. Epidemiology, diagnosis, staging and multimodal therapy of esophageal and gastric tumors. Cancers (Basel). 2021;13(3):582. |
| 29. | Stahl M, Walz MK, Riera-Knorrenschild J, Stuschke M, Sandermann A, Bitzer M, et al. Preoperative chemotherapy versus chemoradiotherapy in locally advanced adenocarcinomas of the oesophagogastric junction (POET): Long-term results of a controlled randomised trial. Eur J Cancer. 2017;81:183-90. |
| 30. | Reynolds JV, Preston SR, O’Neill B, Lowery MA, Baeksgaard L, Crosby T, et al. Neo-AEGIS (neoadjuvant trial in Adenocarcinoma of the Esophagus and Esophago-Gastric Junction International Study): Preliminary results of phase III RCT of CROSS versus perioperative chemotherapy (Modified MAGIC or FLOT protocol). (NCT01726452). J Clin Oncol. 2021;39(15_suppl):4004-4004. |
| 31. | Ajani JA, Barthel JS, Bentrem DJ, D’Amico TA, Das P, Denlinger CS, et al. Esophageal and esophagogastric junction cancers. J Natl Compr Canc Netw. 2011;9(8):830-87. |
| 32. | Conroy T, Galais MP, Raoul JL, Bouché O, Gourgou-Bourgade S, Douillard JY, et al. Definitive chemoradiotherapy with FOLFOX versus fluorouracil and cisplatin in patients with oesophageal cancer (PRODIGE5/ACCORD17): Final results of a randomised, phase 2/3 trial. Lancet Oncol. 2014;15(3):305-14. |
| 33. | Hulshof MCCM, Geijsen ED, Rozema T, Oppedijk V, Buijsen J, Neelis KJ, et al. Randomized study on dose escalation in definitive chemoradiation for patients with locally advanced esophageal cancer (ARTDECO Study). J Clin Oncol. 2021;39(25):2816-24. |
| 34. | Ma GW, Situ DR, Ma QL, Long H, Zhang LJ, Lin P, et al. Three-field vs two-field lymph node dissection for esophageal cancer: A meta-analysis. World J Gastroenterol. 2014;20(47):18022-30. |
| 35. | Lagergren J, Mattsson F, Zylstra J, Chang F, Gossage J, Mason R, et al. Extent of lymphadenectomy and prognosis after esophageal cancer surgery. JAMA Surg. 2016;151(1):32-9. |
| 36. | Sihag S, Nobel T, Hsu M, Tan KS, Carr R, Janjigian YY, et al. A more extensive lymphadenectomy enhances survival after neoadjuvant chemoradiotherapy in locally advanced esophageal adenocarcinoma. Ann Surg. 2022;276(2):312-17. |
| 37. | Kurokawa Y, Takeuchi H, Doki Y, Mine S, Terashima M, Yasuda T, et al. Mapping of lymph node metastasis from esophagogastric junction tumors: A prospective nationwide multicenter study. Ann Surg. 2021;274(1):120-27. |
| 38. | Low DE, Kuppusamy MK, Alderson D, Cecconello I, Chang AC, Darling G, et al. Benchmarking complications associated with esophagectomy. Ann Surg. 2019;269(2):291-98. |
| 39. | Straatman J, van der Wielen N, Cuesta MA, Daams F, Roig Garcia J, Bonavina L, et al. Minimally invasive versus open esophageal resection: Three-year follow-up of the previously reported randomized controlled trial: the TIME trial. Ann Surg. 2017;266(2):232-36. |
| 40. | Leon Takahashi AM, Lopez Basave HN, Lino Silva LS, Fabela Barragan JA, Salcedo Hernandez RA, Herrera Gomez A, et al. 391. Minimally invasive esophagectomy in prone position. Initial experience of National Cancer Institute Mexico. Dis Esophagus. 2022; 35(Suppl 2):doac051.391. Available from URL: https://academic.oup.com/dote/article/35/Supplement_2/doac051.391/6712086 |
| 41. | Kelly RJ, Ajani JA, Kuzdzal J, Zander T, Van Cutsem E, Piessen G, et al. Adjuvant nivolumab in resected esophageal or gastroesophageal junction cancer. N Engl J Med. 2021;384(13):1191-1203. |
| 42. | Doki Y, Ajani JA, Kato K, Xu J, Wyrwicz L, Motoyama S, et al. Nivolumab combination therapy in advanced esophageal squamous-cell carcinoma. N Engl J Med. 2022;386(5):449-62. |
| 43. | Janjigian YY, Shitara K, Moehler M, Garrido M, Salman P, Shen L, et al. First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): A randomised, open-label, phase 3 trial. Lancet. 2021;398(10294):27-40. |
| 44. | Sun JM, Shen L, Shah MA, Enzinger P, Adenis A, Doi T, et al. Pembrolizumab plus chemotherapy versus chemotherapy alone for first-line treatment of advanced oesophageal cancer (KEYNOTE-590): A randomised, placebo-controlled, phase 3 study. Lancet. 2021;398(10302):759-71. |
| 45. | Xu RA, Luo H, Lu J, Bai Y, Mao T, Wang J, et al. ESCORT-1st: A randomized, double-blind, placebo-controlled, phase 3 trial of camrelizumab plus chemotherapy versus chemotherapy in patients with untreated advanced or metastatic esophageal squamous cell carcinoma (ESCC). J Clin Oncol. 2021;39(suppl 15):4000-4000. |
| 46. | Lu Z, Wang J, Shu Y, Liu L, Kong L, Yang L, et al. Sintilimab versus placebo in combination with chemotherapy as first line treatment for locally advanced or metastatic oesophageal squamous cell carcinoma (ORIENT-15): Multicentre, randomised, double blind, phase 3 trial. BMJ. 2022;377:e068714. |
| 47. | Xu J, Jin Y, Liu Y, Zhou H, Wang Y. Abstract CT213: ORIENT-16: Sintilimab plus XELOX vs placebo plus XELOX as 1st line treatment for unresectable advanced gastric and GEJ adenocarcinoma. AACR Annual Meeting Proceedings. 2019. Cancer Res. 2019;79(Suppl 13):CT213. |
| 48. | Wang ZX, Cui C, Yao J, Zhang Y, Li M, Feng J, et al. Toripalimab plus chemotherapy in treatment-naïve, advanced esophageal squamous cell carcinoma (JUPITER-06): A multi-center phase 3 trial. Cancer Cell. 2022;40(3):277-88.e3. |
| 49. | Patel MA, Kratz JD, Lubner SJ, Loconte NK, Uboha NV. Esophagogastric cancers: Integrating immunotherapy therapy into current practice. J Clin Oncol. 2022;40(24):2751-62. |
All Rights Reserved® 2019
Latin American Journal of Clinical Sciences and Medical Technology,Publicación contínua • Editor responsable: Gilberto Castañeda Hernández. • Reserva de Derechos al Uso Exclusivo: 04-2019-062013242000-203; ISSN: 2683-2291; ambos otorgados por el Instituto Nacional del Derecho de Autor. • Responsable de la última actualización de este número, Web Master Hunahpú Velázquez Martínez,
Calle Profesor Miguel Serrano #8, Col. Del Valle, Alcaldía Benito Juárez, CP 03100, Ciudad de México, México. Número telefónico: 55 5405 1396 • Fecha de última modificación, 28 de agosto de 2024.
All Rights Reserved® 2019
Publicación contínua • Editor responsable: Gilberto Castañeda Hernández. • Reserva de Derechos al Uso Exclusivo: 04-2019-062013242000-203; ISSN: 2683-2291; ambos otorgados por el Instituto Nacional del Derecho de Autor. • Responsable de la última actualización de este número, Web Master Hunahpú Velázquez Martínez,
Calle Profesor Miguel Serrano #8, Col. Del Valle, Alcaldía Benito Juárez, CP 03100, Ciudad de México, México. Número telefónico: 55 5405 1396 • Fecha de última modificación, 28 de agosto de 2024.