| ** | Latin American Journal of Clinical Sciences and Medical Technology is an open access magazine. To read all published articles and materials you just need to register Registration is free of charge. Register now If you already have registered please Log In | ** |
aUroanálisis/Metabolismo, Benemérita Universidad Autónoma de Puebla, Puebla, Puebla; bPatología Clínica, Centro Médico ABC, Campus Santa Fe, Ciudad de México, México; cMedicina Crítica, Administración Servicios Enfermería, Hospital Ángeles Clínica Londres, Ciudad de México, México; dMicrobiología, Práctica Privada en la Ciudad de Puebla, Puebla; eEpidemiología, Instituto Nacional de Ciencias Médicas y Nutrición “Salvador Zubirán”, Ciudad de México, México.
Autor para correspondencia: , . Números telefónicos: ; e-mail: galindofraga@yahoo.com
Lat Am J Clin Sci Med Technol. 2022 Jun;4:97-113.
Recibido: 13 de mayo, 2022
Aceptado: 15 de junio, 2022
Publicado: 30 de junio, 2022
Vistas: 65000
Descargas: 189
Un grupo multidisciplinario de expertos desarrolló la Guía de práctica clínica para toma de muestra urinaria en México para promover la calidad preanalítica de la muestra para el análisis de orina y homogeneizar los criterios de toma de muestra, transporte y su conservación. En dicha guía se incluyeron recomendaciones para la solicitud, identificación y preparación del paciente, toma de muestra en mujeres, en hombres y en niños (con y sin control de esfínteres), así como la toma de muestra por punción suprapúbica, manejo y transporte de muestras.
A multidisciplinary group of experts developed Guía de práctica clínica para toma de muestra urinaria en México (Clinical practice guidelines for urine sampling in Mexico) in order to promote the preanalitic urianalysis quality sample and standardize criteria on sampling, transport and preservation. Such guide includes recommendations to request, identification and preparation of the patient, urine specimen collection in women, men, children (with or without sphincter control), as well as for suprapubic aspiration, handling and sample transportation.
El uroanálisis es una herramienta insustituible para el diagnóstico y monitoreo de las enfermedades de vías urinarias, principalmente. Sin embargo, también proporciona datos importantes de otros órganos y tejidos (metabolismo endógeno), de condiciones exógenas (microorganismos, dieta, suplementos, fármacos, drogas, etc.) y del estado fisiológico, fisiopatológico o patológico en condiciones agudas y crónicas de los pacientes. Es por ello que sólo mediante la utilización de la metodología correcta se pueden obtener resultados confiables.
Los procesos clave previos al examen (fase preanalítica) y durante el flujo del trabajo para las áreas de laboratorio clínico incluyen todas las actividades desde el momento en que se ordenan los exámenes de laboratorio hasta que las muestras son recolectadas y se envían al laboratorio o, en su defecto, son transportadas al o a los laboratorios de referencia.
Para analistas clínicos, anatomopatólogos y citotecnólogos, las actividades de pre-examen abarcan desde el momento en que se obtiene la muestra biológica hasta el punto en que son preparadas para la evaluación e interpretación del diagnóstico. Por lo tanto, deben ser contemplados todos los factores que interfieren técnicamente con el método analítico aplicado.
Objetivo
El objetivo de esta Guía de práctica clínica para toma de muestra urinaria en México es presentar la información actualizada para lograr la estandarización de la toma de muestra urinaria en México. Se enfoca, particularmente, en la fase preanalítica, bajo los procedimientos consensados en la literatura científica nacional e internacional en protocolos y normativas.
Alcance
Todo el personal de salud calificado y entrenado para la toma de muestras en pacientes ambulatorios u hospitalizados en el sector público o privado de cualquier institución y nivel de servicio de salud y/o auxiliar en el diagnóstico por laboratorio. El fin es fortalecer las buenas prácticas y proporcionar una guía completa que sea auxiliar para la consulta, aplicación y que garantice la correcta recolección de muestras de orina para su análisis.
Justificación
El profesional de la salud depende, en gran medida, de los resultados obtenidos en el laboratorio para la toma de decisiones clínicas; de modo que es relevante resumir y describir de manera concreta los procedimientos críticos en la metodología durante la recolección de muestra urinaria en la fase preanalítica, ya que es ahí donde se presenta el porcentaje más elevado de errores que afectan la calidad, confiabilidad y oportunidad del resultado.
Metodología
Se convocó a un grupo multidisciplinario y representativo de la infectología, patología clínica, enfermería, microbiología, química, análisis clínico, investigación en salud, pediatría, maternidad, epidemiología, control de infecciones, tamiz, uroanálisis y metabolismo.
Se realizaron búsquedas bibliográficas sistemáticas para cada uno de los temas revisados por los especialistas en una reunión informativa (y en una subsiguiente) con el fin de detectar y resolver los temas de controversia. Las conclusiones se presentan en esta Guía de práctica clínica para toma de muestra urinaria en México.
Dieta
La dieta puede variar considerablemente entre individuos, poblaciones e incluso en el propio paciente entre consumos, cantidad, balance energético, proporciones entre líquidos (diuréticos y no diuréticos) y solutos adquiridos, capacidad de absorción nutrimental, tasa metabólica y tasa excretora. Dietas inapropiadas por hábitos poblacionales o personales pueden modificar las condiciones urinarias físicas, químicas y de sedimento de una muestra de orina entre horarios, inclusive de una toma a otra en un mismo sujeto. Estas variaciones pueden afectar el valor diagnóstico de la muestra recolectada.1
Es recomendable que el último alimento consumido antes de recolectar la muestra urinaria (en el caso de la primera orina de la mañana) sea equilibrado entre grupos alimenticios y en porciones adecuadas según la edad.2 En pacientes pediátricos sin control de esfínter no se aplica la restricción dietética.
Consumo de líquidos (diuresis) y ayuno
Los constituyentes urinarios modifican su excreción real en relación con la cantidad de agua consumida y excretada. Por lo tanto, su concentración o cantidad en la orina varía de acuerdo con el volumen urinario (también denominado tasa de excreción de agua o diuresis). Ejemplo de ello es que la detección de hormonas / drogas / productos químicos tóxicos en una muestra de orina diluida puede dar resultados falsos negativos, por lo que el consumo de líquidos previo a la recolección del espécimen es esencial. Es deseable que la ingesta nocturna tenga un volumen bajo (20 - 50 mL / h) o un consumo máximo de 250 mL para producir muestras altamente concentradas, lo cual se logra mejor en la orina de la mañana.3
El riñón sano es capaz de modificar la osmolaridad urinaria entre 40-1200 mOsm/kg de agua aproximadamente.4 Valores por debajo del rango fisiológico establecen incapacidad de concentración renal, lo cual indica desde condiciones fisiológicas hasta patológicas. Los valores por encima del rango de referencia establecen un bajo consumo de líquidos o una alta excreción de solutos disueltos en la orina.3,5,6 En especímenes fraccionados, cronometrados o de 24 horas no se recomienda variar el volumen de consumo habitual de líquidos. En pediátricos sin control de esfínter no se aplica la restricción de líquidos.6
Es recomendable que el ayuno de una primera colecta de la mañana no exceda las 6 a 8 horas.6-9 El ayuno disminuye los componentes urinarios proporcionados por la dieta (por ejemplo, sal y fosfato), pero aumenta la excreción de metabolitos asociados con el catabolismo, por ejemplo, cuerpos cetónicos y amoníaco.9
Ejercicio y postura corporal
La amplia variación biológica en la composición de la orina está relacionada con la actividad física y la postura corporal. Evitar el ejercicio físico extenuante minimiza esta influencia en el examen de la orina de la primera micción de la mañana.10,11
El ejercicio induce cambios profundos en la hemodinámica renal y la excreción de proteínas. Los procesos tubulares y las tasas de excreción que se modifican con el ejercicio pueden generar proteinuria, albuminuria o hematuria9,10, lo cual está directamente relacionado con el aumento de la presión, tensión y filtración glomerular, a su vez asociadas con la intensidad del ejercicio y no con su duración. Esta excreción del exceso de proteínas es un estado transitorio. Además, como resultado del ejercicio aumenta la excreción de urea, fosfatos, sulfatos, hidrogeniones y, por tanto, la acidez y amoníaco, lo cual afecta el pH urinario y, con ello, a algunos de los elementos formes emitidos, tales como cilindros, cristales y algunas células.11
Los pacientes inmovilizados por reposo en cama también reducen su tasa metabólica, el volumen plasmático, masa ósea, musculo-esquelética y, por ende, su urodinamia; ello cambia drásticamente las características de la orina.12,13
La excreción de urea se modifica en función de la masa muscular y aumenta en la orina posterior a una mayor tasa catabólica debido a que este tejido contiene un alto porcentaje de proteínas y la urea es el catabolito final.14 La masa del músculo esquelético genera creatinina como el catabolito final de su metabolismo energético15-18, por lo que a medida que se degenera el músculo, disminuyen los valores de creatinina.16,19,20 Además, se ha reportado que la excreción urinaria de calcio aumenta más del doble en pacientes inmovilizados o en reposo en cama.21,22
Tiempo de incubación en la vejiga
Para demostrar un crecimiento bacteriano confiable, el consejo microbiológico clásico ha sido permitir a las bacterias una fase logarítmica de crecimiento mediante la incubación de la orina en la vejiga durante 4-8 horas.23
La orina es un buen medio de cultivo para muchas bacterias. Indirectamente, con el método de Griess (reacción del nitrito en las tiras reactivas) se ha demostrado que la primera muestra de orina de la mañana es más sensible para detectar bacteriuria asintomática en mujeres embarazadas que las muestras posteriores. Sin embargo, no es una prueba definitiva, ya que existen bacterias que bioquímicamente no transforman los nitratos urinarios en nitritos, otras que los pueden transformar, pero no lo hacen todo el tiempo (es decir, transforman a nitritos a necesidad) y otras más que poseen una tasa de biotransformación tan rápida que convierten nitratos a nitritos y nitritos a óxido nítrico bajo la influencia de un pH ácido.24-26 Asimismo, en bacterias adheridas o formadoras de colonias intracelulares existe una baja capacidad de dicha biotransformación.27,28 En todos los casos se debe considerar la urodinamia del paciente para establecer el tiempo mínimo de permanencia de la orina en vejiga (incontinencia, afecciones de esfínter, procesos de oliguria o anuria).
En las pautas más recientes para la evaluación de nuevos medicamentos antinfecciosos no se mencionan los tiempos de incubación en vejiga. La urgencia de la micción asociada con la infección aguda a menudo no permitirá suficiente tiempo de incubación de la vejiga antes de vaciar, lo que puede generar cultivos falsos negativos.26
Para el análisis químico no es necesario un tiempo de incubación particular, inclusive para la detección de alteraciones relacionadas con la homeostasis de glucosa, proteínas y bilirrubinas. Cualquier orina al azar sin un tiempo determinado en vejiga es adecuada para su análisis.29 Al estudiar la morfología celular y estructuras del sedimento, los mejores resultados se obtienen con un tiempo de incubación corto de 1-2 horas. La búsqueda intencionada de cilindros se puede realizar en orinas con tiempos de incubación de 1-3 horas, siempre que una alta diuresis no conduzca a resultados falsos negativos.30
Contaminación
Las muestras de orina se deben recolectar sin líquidos contaminantes internos ni externos. Las relaciones sexuales deben evitarse en el caso de mujeres durante un día antes de la recolección, mientras que para varones el tiempo de abstinencia deberá ser al menos de tres días antes de la colecta del espécimen primario debido al aumento en la cantidad de proteínas y células resultante.31,32 En la orina de las mujeres, el contacto coital puede condicionar mayor exfoliación de celularidad uretral, así como promover infiltrados leucocitarios característicos de una inflamación postcoital. La vaginitis no infecciosa puede generar piuria debido a las interconexiones de la glándula de Skene (próstata femenina). Además, las secreciones vaginales o la sangre menstrual pueden contaminar la muestra de orina, por lo que se recomienda esperar tres días después del último día de la menstruación. El embarazo se asocia con piuria fisiológica.32-34
En hombres, la orina generalmente está contaminada con pequeñas cantidades de productos secretores de la próstata, lo cual se exacerba después del coito. La excreción de N-acetil-D-glucosaminidasa, y de otras proteínas prostáticas que son marcadores de daño renal, aumentan y se mantienen durante tres días después de la eyaculación. El líquido seminal puede contaminar la orina después de la eyaculación, pero también en enfermedades neurodegenerativas que afectan los vasos deferentes, epidídimo y próstata se asocian con la presencia de seminuria y espermaturia (también llamada urospermia).31,32,35-38
La información de la ficha de identificación debe ser suficiente, clara, oportuna y veraz. Se debe notificar al paciente acerca de los procedimientos a los que será sometido. En cuanto a la obtención de la muestra urinaria, se deberán proporcionar las indicaciones necesarias con el fin de implementar criterios preanalíticos aceptables. Los datos que deberán incluirse son:
- Nombre completo del paciente
- Fecha de nacimiento, edad
- Fecha y hora de la recolección de la muestra
- Procedencia de la muestra (catéter, primera orina de la mañana, chorro medio, etc.)
- Examen solicitado
- Medicamentos (en caso de que aplique)
- Diagnóstico (en caso de que aplique)
De acuerdo con las diferentes guías de urología y nefrología, se puede solicitar un análisis de orina en muestras obtenidas por micción espontánea, al azar, cronometrada, fraccionada, por cateterismo, punción suprapúbica, mediante una urostomía postoperatoria o uso de diferentes recipientes de recolección. La muestra comúnmente obtenida es el chorro medio de la primera orina de la mañana. El personal clínico solicitante debe documentar el método de recolección para permitir la interpretación correcta de los resultados.
Procedimientos para la recolección de orina39-41
Los requisitos microbiológicos generalmente determinan los detalles de cualquier método de recolección, ya que la orina destinada al examen microbiológico debe evitar:
- Contaminación de las muestras por bacterias comensales
- Crecimiento bacteriano tras recolectar las muestras
- Daño o muerte de bacterias relevantes para el diagnóstico
- Degeneración o generación de elementos formes que proporcionen información valiosa para el diagnóstico
Orina de chorro medio
Es la porción media de la muestra recolectada. La primera porción de orina no se recolecta porque siempre está contaminada por la urobiota comensal uretral en ambos sexos. Este tipo de recolección minimiza la contaminación de las muestras por bacterias comensales; es especialmente importante y requiere un asesoramiento detallado del paciente. Es esencial lavar el introito alrededor de la uretra en las mujeres y el glande del pene en los hombres, sólo con agua, antes de la micción porque ello reduce los cultivos de orina falsos positivos en 20% o más.40,41
No se recomienda el uso de antisépticos porque pueden afectar la viabilidad bacteriana.42-44 La última porción también se elimina después de recoger un volumen aproximado de entre 50-100 mL de orina en el recipiente. El uso de diferentes dispositivos estériles puede ayudar a las mujeres a orinar más fácilmente en un recipiente de recolección. Las instrucciones detalladas para la recolección de orina de chorro medio se describen a continuación. Se recomienda que las indicaciones vayan acompañadas pictográficamente.
Mujeres
- Lavarse las manos con agua y jabón (al menos 20 segundos) y secar perfectamente
- Contar con el recipiente de recolección limpio, nuevo y de preferencia estéril, listo para la recolección
- Evitar tocar el interior del recipiente con los dedos
- Lavar los órganos genitales externos, incluido el orificio por donde orina, con agua o toallitas individuales y secar con una gasa
- Eliminar el primer chorro de orina al inodoro
- Recolectar la porción media y, una vez que se tenga el volumen adecuado en el recipiente, orinar nuevamente en el inodoro
- Al terminar, cerrar el frasco de orina y asegurarse de que no presente fugas
- Si es necesario, secar el exterior del recipiente
- Si se cuenta con tubos al vacío para orina, transferir la muestra a estos tubos, permitiendo que el vacío se agote (se recomienda revisar el orden y especificaciones del fabricante)
- Escribir y verificar los datos de identificación, la fecha y hora en que se recolectó la muestra en la etiqueta del recipiente y tubos
- Cerciorarse de que no haya fugas o derrames en el recipiente o en los tubos y transportar la muestra al laboratorio antes de las dos horas (Figura 1)45

Hombres
- Lavarse las manos con agua y jabón; y secarlas perfectamente
- Contar con el recipiente de recolección limpio, nuevo y de preferencia estéril, listo para la recolección
- Evitar tocar el interior del recipiente con los dedos
- Lavarse los genitales externos. Destapar la abertura uretral (retirar el prepucio si es necesario). Lavar el extremo del pene (incluido el orificio por donde orina) con agua o toallitas individuales. Secar con una gasa
- Al orinar, eliminar el primer chorro de orina directamente al inodoro
- Recolectar la porción media y una vez que se tenga el volumen adecuado en el recipiente, orinar nuevamente en el inodoro
- Al terminar, cerrar el frasco de orina y asegurarse de que no presente fugas
- Si es necesario, secar el exterior del recipiente
- Si se cuenta con tubos al vacío para orina, transferir la muestra a estos tubos, permitiendo que el vacío se agote (se recomienda revisar el orden y especificaciones del fabricante)
- Escribir y verificar los datos de identificación, la fecha y hora en que se recolectó la muestra, en la etiqueta del recipiente y tubos.
- Cerciorarse de que no haya fugas o derrames en el recipiente o en los tubos y transportar la muestra al laboratorio antes de las dos horas (Figura 2)

Muestra aleatoria
La muestra se recolecta en cualquier momento, pero el tiempo real de recolección (vaciamiento de vejiga) debe registrarse en el recipiente contenedor.45
Primera muestra de la mañana
Normalmente se recolecta justo después de que el paciente se despierta del sueño nocturno y se le conoce como una muestra «nocturna», «ocho horas» o «primera orina de la mañana». Esta muestra se retuvo en la vejiga durante aproximadamente ocho horas y es la orina más concentrada del día. La muestra también es más ácida; por lo tanto, los elementos formados como las células y los cilindros son más estables que en la orina diluida y menos ácida.45
Muestra de chorro medio de la primera orina de la mañana para urocultivo
Normalmente se recolecta justo después de que el paciente se despierta del sueño nocturno y se le conoce como una muestra «nocturna», «ocho horas» o «primera orina de la mañana». Se utiliza en la búsqueda intencionada de microorganismos como bacterias grampositivas y negativas, Gardnerella vaginalis, Chlamydia trachomatis, Neisseria gonorrhoeae, Ureaplasma urealyticum, micoplasmas, rickettsias, micobacterias, hongos, ácaros e infecciones urinarias virales.43,44 Este tipo de recolecta es recomendable para estudios de histopatología dirigidos; sin embargo, deber ser establecido por el médico solicitante.45-47
Niños capaces de controlar esfínter
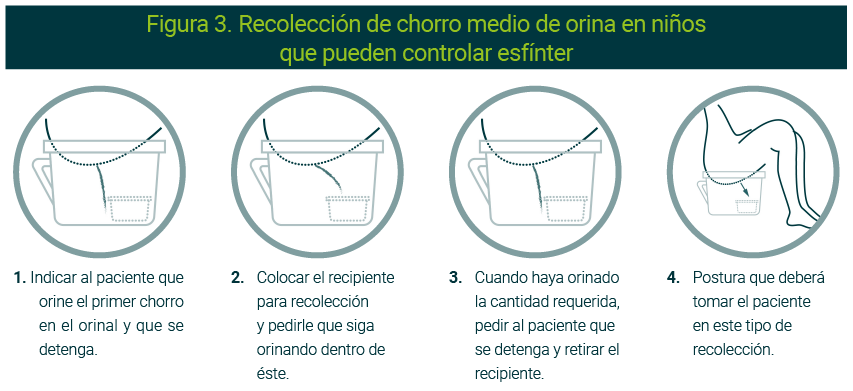
Después de una explicación apropiada, se pueden recolectar especímenes de flujo medio razonablemente adecuados de niños lo suficientemente mayores como para sentarse en una silla para ir al baño. Esto se puede lograr colocando el recipiente de recolección en el orinal. Los niños mayores pueden seguir los mismos consejos que se les dan a los adultos. Después de recolectar la muestra, limpiar y secar la superficie exterior del recipiente, asegurar la tapa o transferir la orina a los tubos provistos, y escribir o verificar el nombre del niño, la fecha y hora en que se recolectó la muestra en la etiqueta del recipiente (Figura 3).45,48,49
Niños sin control de esfínter
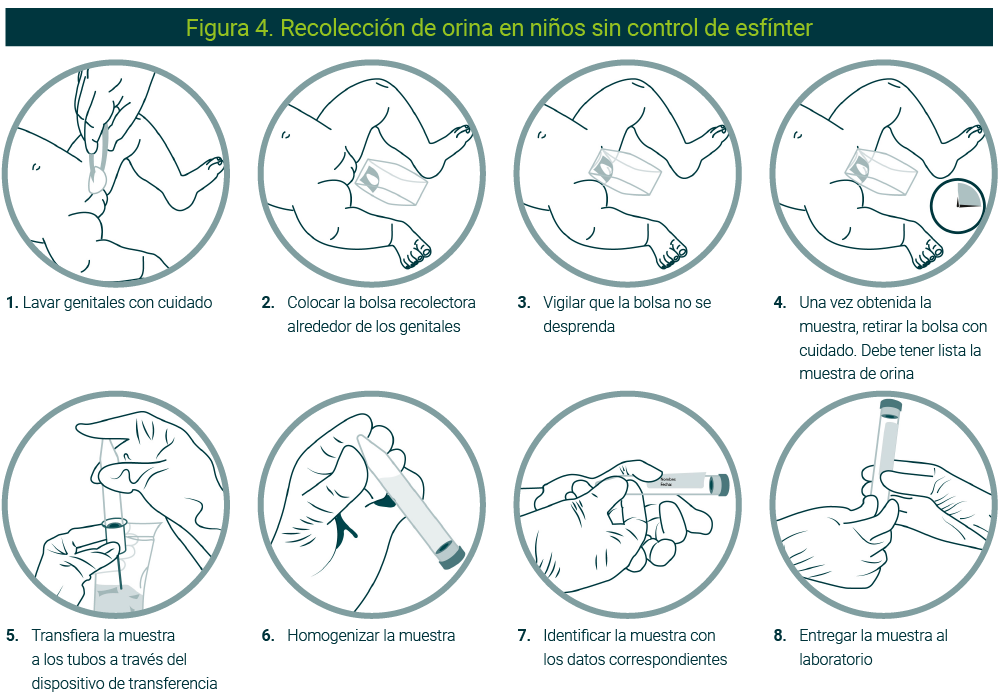
En pacientes pediátricos que no controlan esfínteres, la orina se recolecta en bolsas estériles (especialmente diseñadas para ellos) de la siguiente forma:
- Después de lavar cuidadosamente los genitales y área perineal (igual que en los adultos para eliminar contaminantes como talco, pomada, restos de fibras del pañal, etc.), tener a la mano una bolsa recolectora y un frasco contenedor hermético y estéril
- Colocar la bolsa de plástico, procurando que tenga aire al momento de la colocación
- No vestir ni colocar el pañal y procurar que mantenga las piernas abiertas para no presionar la bolsa recolectora
- Vigilar la bolsa recolectora cada 15 minutos (cambiarla cada hora en caso de que no haya micción)
- Cuando el niño haya orinado, retirar con cuidado la bolsa y verter su contenido en el frasco contenedor
- Tapar el frasco y conservarlo protegido de la luz directa del sol o de fuentes de calor (no refrigerar)
- Rotular el frasco con el nombre completo del paciente, edad, fecha y hora de recolección
- Transportar la muestra al laboratorio antes de que transcurran dos horas después de la micción
- Informar si el paciente pediátrico está tomando algún medicamento (Figura 4)48-50
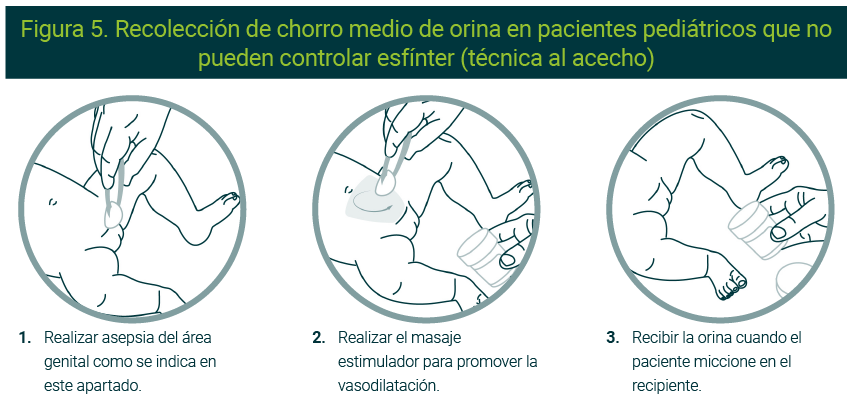
La recolección de la muestra primaria en pediátricos sin control de esfínter también se puede realizar al acecho. En esta técnica, también posterior a la limpieza de los genitales, se destapa un frasco estéril y con una torunda embebida en alcohol se le realiza un masaje estimulador a la altura de la vejiga de manera circular para promover vasodilatación, y con ello acelerar la micción. Es importante no entrar en contacto con la zona genital para evitar la contaminación de la muestra (Figura 5).51-54
Muestra a través de catéter vesical
El catéter vesical ayuda a drenar la orina y se debe colocar con una técnica estéril. Es uno de los métodos recomendados para obtener una muestra de orina estéril en los pacientes que se requiera confirmar o excluir la presencia de infección urinaria.55-57 Es fundamental mantener un sistema cerrado para evitar la desconexión del catéter vesical y el tubo de drenaje, ya que esto puede aumentar las infecciones del tracto urinario asociadas a catéter.58
Las muestras no deben ser tomadas de la bolsa recolectora porque podría estar contaminada.
Muestra de orina a través de sonda vesical
Se recomienda que los sistemas de recolección de orina tengan las siguientes características59:
- Ser estéril
- Tener uniones selladas
- Contar con un puerto para toma de muestra y aspiración de la orina autosellable y libre de agujas en el lado distal de la sonda
- Tener un sistema recolector con válvula antirreflujo para evitar la ascensión intraluminal de los microorganismos a la vejiga
- Contar con llave de vaciado con pinza para manipulación
La toma de muestra debe contemplar:
Material
- Adaptador integrado para toma de muestra
- Tubo con conservador para urocultivo
- Tubo con conservador para examen general de orina
- Toallita de alcohol isopropílico al 70%
- Guantes
- Equipo de protección personal
Procedimiento60,61
- Realizar lavado de manos
- Reunir material a utilizar
- Rotular etiquetas
- Preparar material a utilizar (abrir la toallita de alcohol isopropílico al 70%. Abrir el empaque del adaptador para toma de muestra)
- Realizar higiene de manos
- Colocar guantes
- Presentarse con el paciente y explicar el procedimiento
- Asegurar que el paciente se encuentre cómodo y que tenga privacidad
- Pinzar el tubo recolector lo más cerca posible al puerto de toma de muestra. Verificar el protocolo de la institución
- Desinfectar el puerto con toallitas alcoholadas al 70% de acuerdo con las políticas de la institución
- Colocar el adaptador en el puerto de toma de muestra, empujando y enroscando en sentido de las manecillas del reloj
- Tomar el tubo con conservador para urocultivo para examen de urocultivo, insertar, empujar y mantenerlo en posición vertical, mantener presión constante hasta agotar el vacío del tubo. Al terminar, homogenizar el tubo de acuerdo con las indicaciones del fabricante
- En caso de requerir muestra para examen general de orina, utilizar el tubo con conservador; insertar, presionar y mantenerlo en posición vertical y a presión constante hasta agotar el vacío del tubo. Al terminar, homogenizar de acuerdo con las indicaciones del fabricante
- Después de retirar el último tubo de muestra, retirar el adaptador para toma de muestra por medio de un giro en contra de las manecillas del reloj. Desechar el adaptador para toma de muestra en un contenedor rígido para punzocortantes
- Limpiar el puerto con toallitas de alcohol isopropílico al 70%
- Despinzar el tubo de drenaje
- Retirar guantes y desecharlos correctamente
- Cubrir al paciente y dejarlo cómodo
- Colocar membrete en el/los tubo(s)
- Entregar las muestras al laboratorio (Figura 6)

Muestras de urostomía (orina del conducto ileal)
Estas muestras se obtienen con frecuencia después de la cirugía de vejiga. Los pacientes pediátricos y adultos con uréteres dilatados pueden recibir ureterostomías bilaterales.
Las infecciones crónicas y el sangrado en el sitio del estoma son comunes. Limpiar el estoma y desechar la primera porción de orina, obtenida a través de un catéter estéril de tamaño adecuado, garantiza la calidad de la muestra.62
La recolección de segmentos específicos del flujo de orina puede ayudar a definir áreas anormales del tracto urinario que pueden necesitar atención urológica. Luego se establecen las acciones a realizar entre el médico solicitante y el laboratorio, lo cual es esencial antes del procedimiento para garantizar:
- Origen de la muestra (uréter izquierdo / derecho, vejiga, etc.)
- Identificación de cualquier bacteria a niveles bajos (<104 CFB / L o <101 UFC /mL)
- Inóculos de orina grandes, que pueden utilizarse para asegurar un recuento preciso de placas (10 - 100 µL)
- Informar simultáneamente las concentraciones relativas en cada sitio anatómico
- Sensibilidad a los antibióticos de cualquier bacteria cultivada
La toma de muestra de orina mediante urostomía con sonda debe contemplar62,63:
Material
- Solución antiséptica
- Dos paquete de gasas estériles
- Catéter vesical (16Fr)
- Frasco estéril para recolección de orina
- Guantes limpios y estériles
- Campos estériles
- Solución estéril
- Riñón estéril
- Bolsa de urostomía nueva
Procedimiento
- Realizar lavado de manos
- Reunir material a utilizar
- Presentarse con el paciente y explicar el procedimiento
- Colocar al paciente en una posición que le resulte cómoda y que tenga privacidad
- Preparar el material a utilizar manteniendo la esterilidad
- Realizar higiene de manos
- Colocar guantes limpios
- Colocar campos estériles para absorber
- Retirar con cuidado la bolsa de urostomía
- Realizar lavado de manos
- Colocar guantes estériles
- Realizar limpieza del estoma con la solución indicada por su institución con movimientos circulares de la apertura del estoma a la periferia
- Tomar el estoma con una gasa estéril
- Colocar el extremo abierto del catéter en el recipiente de la muestra
- Lubricar el catéter con un poco de agua, introducir de manera gentil el catéter entre 5 y 7 centímetros, no forzar si se detecta resistencia; gire el catéter hasta que se deslice dentro del estoma
- Sujetar el catéter en la misma posición hasta que empiece a drenar orina. Recolectar la cantidad requerida por su institución
- Retirar el catéter con cuidado
- Limpiar y secar el estoma y la zona periestomal
- Colocar la nueva bolsa de urostomía y asegurarse de que quede bien sellada
- Etiquetar muestra y enviar a laboratorio
Muestra de 24 horas
Una muestra de orina fraccionada, cronometrada o de 24 horas son ejemplos de recolecciones de orina de tiempo controlado. En general, este tipo de recolección busca la concentración de una o más sustancias durante el período definido, ya que en una muestra aleatoria o primera de la mañana no se puede establecer este parámetro. No está indicada para observar elementos formes, para lo cual se recomienda el uso de diferentes conservadores, según los mencionados en la Guía Europea de Uroanálisis y en las Guías para el análisis de orina de la CLSI, GP16-A3.
Además, el analista debe tener en cuenta que el desarrollo técnico de estas mediciones se asocia con la medición sérica del analito y los cambios en el fluido corporal. Es primordial considerar que las Guías KDIGO para el diagnóstico de la función renal ya no recomiendan recolecciones de 24 horas debido a las múltiples interferencias y errores analíticos que resultan de la recolección de esta muestra.29,64
Las indicaciones de recolección del profesional de la salud deben ser claras y precisas para evitar errores analíticos relacionados con la recolección de la muestra.
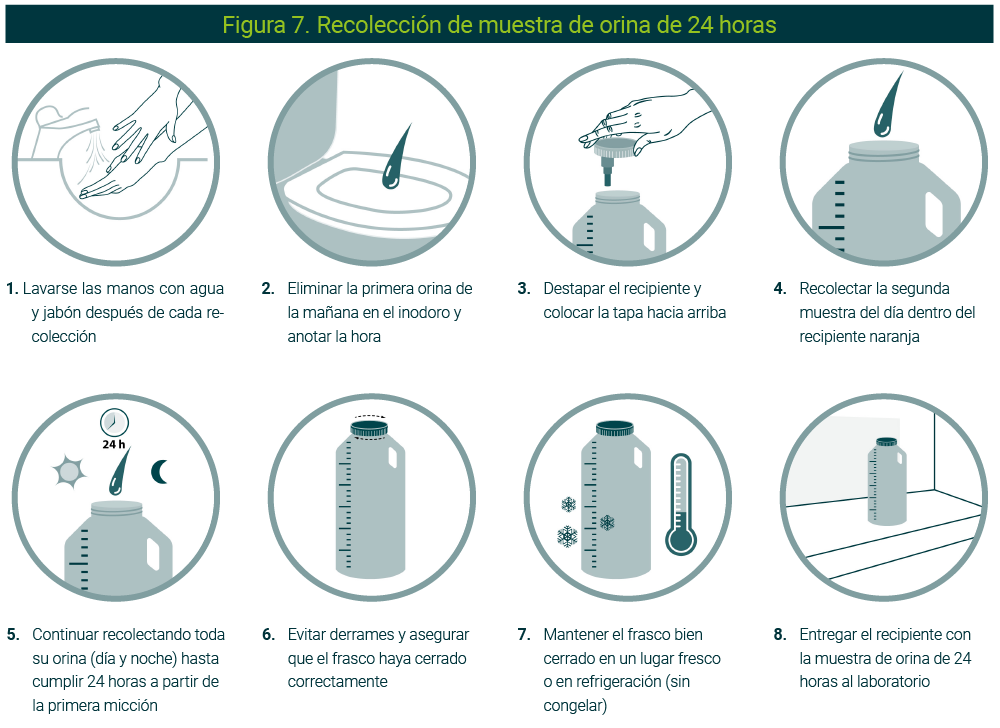
La recolección puede necesitar conservadores (para un análisis confiable) que generalmente se agregan al contenedor de recolección antes del inicio o inmediatamente después de la primera orina recolectada (recomendación en un paso más adelante). Las recomendaciones son (Figura 7):
- Contar con el contenedor adecuado (ámbar, boca ancha, con medición de volumen)
- Realizar lavado de manos previo a cada recolección
- Destapar el contenedor y dejar la tapa hacia arriba, evite tocar el interior del contenedor
- La primera orina debe ser eliminada en el inodoro
- La siguiente orina debe colocarse en su totalidad directamente en el contenedor
- Exactamente 24 horas después de comenzar la recolección, vaciar la vejiga y agregar esta última orina en su totalidad al contenedor de recolección
- Anotar la fecha y la hora en que comienza la recolección (puede elegir cuándo comenzar)
- Cada recolección de orina requiere de un aseo como se indicó en casos anteriores
- Cerrar el recipiente, limpiar y secar perfectamente
- Colocar la etiqueta provista en el recipiente. Escribir o verificar los detalles de los horarios de recolección y los datos de identificación del paciente
- Almacenar y transportar el contenedor al laboratorio, cerciorarse de que no haya fuga ni derrames de la muestra
- Si sólo se solicitó una parte de la muestra de 24 horas, mezclar de manera homogénea la recolección completa antes de verter la alícuota en el recipiente proporcionado de menor volumen
- Limpiar y secar perfectamente el recipiente pequeño y colocar la etiqueta provista en él
- Verificar o escribir nombre, identificación personal, fecha y hora de recolección detallada en la etiqueta, así como información necesaria dependiendo del análisis a realizar
Recolección de muestra urinaria por aspiración suprapúbica65-68
La mejor técnica para obtener muestras de orina no contaminadas en neonatos y lactantes es la aspiración directa de la vejiga (localización intrabdominal) mediante una punción suprapúbica (PSP) porque evita su paso por la uretra.3,4
En caso de fimosis, no hay alternativa aceptable y debe realizarse por esta técnica.
Una sola muestra puede asegurar o descartar infección del tracto urinario, aun con recuentos bacterianos bajos. Aunque sencilla, su tasa de éxito para obtener orina es muy variable (23-90%) e inferior a la de la sonda vesical (SV). Es más difícil en mayores de un año. Se facilita con control ecográfico.
Indicaciones
Obtención de orina para su análisis y cultivo en condiciones estériles en menores de dos años, cuando:
- El cuadro clínico no admite demorar el tratamiento
- Hay riesgo de contaminación (gastroenteritis, vaginitis, uretritis, balanitis, dermatitis perineal),
- Existen resultados previos equívocos
- La SV no es posible por fimosis grave, anomalías de uretra o de vulva o sinequias
Contraindicaciones
- Vejiga vacía (micción reciente, deshidratación)
- Infección de la piel en el sitio de punción
- Dilatación o visceromegalias abdominales
- Diátesis hemorrágica
Equipo estéril
- Agujas de 22-23 gauge (también de 25 a 21), 1-1.5 pulgadas
- Jeringuilla de 5 mL
- Guantes, gasas o algodón
- Solución antiséptica de povidona yodada o alcohol
Técnica68,69
- Es esencial saber si hay orina en la vejiga por palpación de fondo vesical (por encima de pubis o con ecografía) para asegurar el éxito y evitar complicaciones. Es preferible utilizarla si no se orinó en la última hora y mejor tras 20 minutos de una toma
- Ayudantes: sujetan al niño en decúbito supino con muslos en abducción; presión suave sobre pene o rectal anterior en niñas para evitar la micción
- Limpieza de piel suprapúbica con antiséptico
- Localizar el punto de punción: línea media, 1-2 cm encima de sínfisis púbica (Figura 8B)
- Aguja: situar perpendicularmente a la piel (Figura 8C) y ligeramente caudal (10-20º). Avanzar con succión suave hasta que entre orina en la jeringuilla (profundidad de 2 a 3 cm; al penetrar en vejiga se puede sentir una leve disminución de resistencia). Aspirar orina suavemente
- Retirar la aguja: poner un capuchón estéril en la jeringuilla o transferir la orina a un recipiente estéril y enviar para cultivo
- Si no se obtiene orina, retirar la aguja (no redirigirla) y esperar al menos 1 hora para intentarlo de nuevo
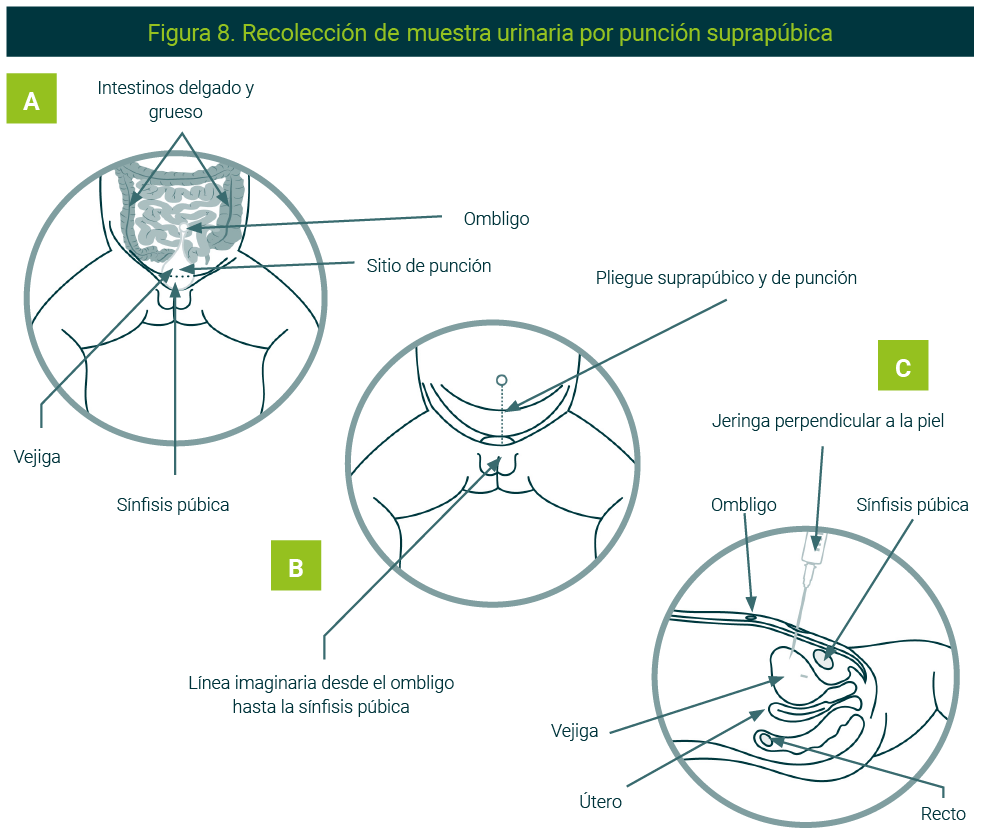
Complicaciones
Son raras, a saber;
- Hematuria transitoria, microscópica la mayoría, macroscópica el 2%
- Perforación intestinal: contaminación de la muestra (flora mixta)
- Infección
Pruebas de orina complementarias
Toma de muestras de orina secuenciales para el pronóstico de prostatitis bacteriana crónica y trastornos relacionados
Particularmente, la próstata y el tracto urinario inferior son objeto de investigación. Para el diagnóstico de prostatitis bacteriana crónica aún se recomienda el procedimiento de recolección de Meares y Stamey, en el cual se deben recolectar las porciones de orina de primer y medio flujo, luego el volumen urinario generado por medio de un masaje de próstata (generalmente gotas), y la muestra final se anula después del masaje prostático. Para dicho diagnóstico, la recolección secuencial de las porciones primera y media de una muestra es de valor diagnóstico, así como la secreción generada con masaje prostático y orina después del masaje prostático.
Los resultados son mejores si el paciente no ha eyaculado al menos durante tres días antes de la recolección de la muestra. Las instrucciones deben seguirse con la asistencia del médico que realiza el examen70-74:
- Beber 400 mL de agua media hora antes de la recolección de la muestra. El examen comienza con la siguiente micción
- Etiquetar cuatro recipientes de recolección estériles (A - D). Evitar tocar el interior de los vasos o cierres
- Lavarse las manos con agua y jabón, con gel antibacterial o con una toallita desinfectante (al menos 20 segundos) y secar perfectamente
- Alistar el recipiente de recolección limpio y estéril
- Destapar la abertura uretral retirando el prepucio. Lavar el extremo del pene, incluido el orificio por donde orina, con una ducha de mano o con agua tibia y toallas de papel (o toallitas estériles) sin usar desinfectantes. Secar perfectamente
- Orinar de 10 a 15 mL en el primer recipiente (A) de pie
- Orinar de 100 a 200 mL en el inodoro. Sin interrumpir la corriente, orinar de 10 a 15 mL en el segundo recipiente (B). El resto de la micción eliminarla nuevamente al inodoro
- Inclínese hacia adelante y sostenga el contenedor de muestras estériles (C) para recolectar la secreción de la próstata mientras el médico masajea la próstata. Se necesitan varias gotas
- Si no hay secreción visible durante el masaje, el médico recoge una muestra con un asa de 10 µL del orificio uretral para el cultivo directo
- Después del masaje prostático, intentar orinar de 10 a 15 mL, en el recipiente (D)
- Los contenedores A - D deben enviarse para cultivo bacteriano. Si es posible, el análisis del sedimento también es de valor diagnóstico, después de la inoculación de las placas
La estabilidad de las muestras de orina es clave para asegurar la confiabilidad de los resultados; de modo que es recomendable implementar algún sistema de conservación como la refrigeración o la utilización de conservadores químicos que permitan mantener estable la muestra hasta su procesamiento. Se han empleado diversos compuestos químicos para conservar este tipo de especímenes, algunos de los más utilizados se enlistan en la Tabla 1.
| Tabla 1. Conservadores para muestras de orina | |
|---|---|
| Conservador | Características |
| Ácido bórico | Se utiliza en proporción de 1% con relación al volumen final de muestra de orina. Se recomienda para la preservación de la carga bacteriana, glucosa, hidroxiprolina, ácido 5-hidroxiindolacético, proteínas totales y urea; sin embargo, si la concentración de ácido bórico no es la adecuada, puede interferir en las determinaciones químicas. Debido a la naturaleza ácida de este conservador, se recomienda utilizar mezcla de sales que actúen como un sistema de amortiguación de pH, ya que algunas bacterias son susceptibles a pH ácido. Es un conservador de elección en los protocolos de recolección de orina de 24 horas para la medición de biomarcadores en la dieta.75-79 |
| Clorhexidina | Se utiliza como conservador de orina en una concentración de 0.4mM. Previene el crecimiento bacteriano y es útil como conservante de glucosa. Se debe tomar en cuenta la implementación de un sistema de amortiguación de pH en conjunto con la clorhexidina para mantener la estabilidad de la muestra de orina con respecto a este parámetro.79,80 |
| Ácido clorhídrico | Se utiliza como conservador de orina en una concentración de 6 mol/L. Su uso es recomendado en la preservación de aminoácidos, calcio, catecolaminas, citrato (1 día), cistina (7 días), ácido homovalínico, hidroxiprolina, ácido 5-hidroxiindolacético, metanefrinas, oxalato, fosfato y ácido vanilmandélico (pH 3 -5). No se recomienda cuando se pretende cuantificar 5-aminolevulinato (o delta-), cloruros, elementos formes del sedimento y uratos.45,81,82 |
| Etil parabeno | Se utiliza como conservador de orina en una concentración de 5.6%83, así como antimicrobiano.84 |
| Propionato de sodio | Se utlliza como conservador de orina en una concentración de 96%83, y funciona como antifúngico.85 |
| Bicarbonato | Se utiliza como conservador en proporción de 1% en relación al volumen final de la muestra de orina. Se emplea cuando se realiza la cuantificación de 5-aminolevulinato (o delta-), porfirinas y urobilinógeno. No se recomienda su uso si se cuantificara calcio o sales de calcio.77-80 |
| Timol | Se utiliza como conservador en su forma comercial de una tableta por cada 30 ml de orina. Se emplea para conservar muestras de orina a las cuales se realizará el examen químico por tira reactiva; sin embargo, ha tenido un uso limitado debido a que puede interferir con algunas pruebas para determinación de proteínas.81 |
| Cloroformo | Se emplea para inhibir el crecimiento bacteriano. No es recomendado para realizar lectura de sedimento urinario, ya que causa cambios celulares.77-80 |
| Tolueno | Se utilizan 2 ml de tolueno para 100 ml de orina. Es un conservador para cetonas, proteínas y sustancias reductoras; sin embargo, no es eficaz contra las bacterias.81 |
| Formalina | Se utiliza una gota de formalina por cada 30 ml de orina. Es un conservador para realizar uroanálisis; sin embargo, en elevadas concentraciones precipita proteínas, lo cual da como resultado falsos positivos.81 |
Las muestras de orina para estudios de microbiología que no son procesadas dentro de las dos primeras horas después de su recolección pueden conservarse en refrigeración a 4º C sin conservador.81,82,86
La recolección estéril de orina es importante para determinaciones microbiológicas, pero también para algunas mediciones químicas.
La esterilidad de los recipientes de recolección significa que el interior del recipiente sin abrir y sin usar está libre de contaminantes microbianos/químicos que interfieren. Entonces, la esterilidad de un recipiente se refiere a la reducción del crecimiento bacteriano a una probabilidad de un sobreviviente en un millón, como sucede después de la irradiación. Sin embargo, los fabricantes de contenedores deben documentar el cumplimiento de su producto con el uso clínico previsto.
Es menester recordar que al analizar el sedimento urinario de manera clásica (o por un método visible o de amplificación de material genético) se detectarán incluso las bacterias muertas. Además, dado que los desechos son un problema cada vez más preocupante a nivel mundial, se fomenta el desarrollo de nuevos materiales inocuos para el medio ambiente para todos los envases desechables. Finalmente, los envases deben cumplir con las directrices para dispositivos médicos, para recolecta de orina y su estudio ex vivo.45,87-89
El diseño de contenedores de recolección debe permitir la detección de bacterias uropatógenas, incluso en situaciones especiales, es decir, a un nivel tan bajo como <104 CFB/L (equivalente a 101 CFU / mL).
El recipiente de recolección primario debe estar completamente limpio, estéril y tener una capacidad de al menos 50 a 100 mL. Debe tener una abertura de al menos 5 cm de diámetro para permitir que tanto hombres como mujeres recolecten fácilmente la orina. Debe tener una base ancha para evitar derrames accidentales y debe cerrar herméticamente para que pueda transportarse y almacenarse sin fugas.
El recipiente y su tapa deben estar libres de sustancias interferentes y no deben absorber ni cambiar los componentes de la orina. Las partes del recipiente y su tapa (que entran en contacto con la orina) no deben contribuir a la contaminación microbiana después de la recolección de la muestra. Para el caso especial de estudio de bilirrubinas, urobilinógeno, porfirinas, mioglobina y catecolaminas, los frascos deben ser de color oscuro, con la finalidad de que la luz no descomponga o altere a los analitos.45,90,91
Las tasas de excreción fraccionadas, cronometradas y de 24 horas son importantes para la medición de muchos componentes químicos de manera cuantitativa, por lo que normalmente requieren de recipientes o contenedores de volúmenes mayores a 250 mL.
Los contenedores diseñados para una recolección de orina de 24 horas o de orina cronometrada por 12 horas durante la noche deben tener una capacidad de entre 2-3 L. Deben estar fabricados con materiales que eviten la adherencia de los componentes de la orina y la exposición de la orina a la luz directa, lo cual podría alterar metabolitos clínicamente significativos, contaminación del exterior cuando está cerrado. Los estabilizadores generalmente evitan los cambios metabólicos y de otro tipo en los componentes de la orina. El recipiente debe permitir el uso de conservantes recomendados.
Los recipientes secundarios (para análisis de orina básicos, generalmente tubos de examen) deben llenarse fácilmente desde el recipiente primario sin riesgo de derrame. El tubo debe ser translúcido para permitir una visión clara de la muestra. Debido a un riesgo considerable de errores y contaminación, la investigación se orienta hacia el desarrollo de sistemas de vacío, lo que permite la aspiración directa de la muestra en un recipiente secundario.
Las muestras pueden transportarse en contenedores primarios o dividirse en alícuotas que pueden variar de 1 a 100 mL para investigaciones químicas y de elementos formes.
Para el análisis microbiológico, 1-3 mL de orina en un recipiente limpio y estéril es suficiente. Para laboratorios con equipos automatizados, un recipiente estandarizado con un volumen de 3 a 12 mL es esencial para los sistemas analíticos.90,92
Todos los recipientes de muestras deben estar rotulados con una etiqueta que permanezca adherida aún cuando la muestra sea refrigerada. La etiqueta debe incluir un código de barras (si está establecido por el laboratorio), un código del examen solicitado, la identificación del paciente, la unidad solicitante (si aplica), así como detalles del tiempo de recolección, método de recolección y cualquier información preanalítica adicional en forma codificada. Los detalles de cualquier conservador deben mostrarse en una etiqueta separada e incluir cualquier símbolo de peligro apropiado. El etiquetado no debe evitar una visión clara de la muestra. La etiqueta debe colocarse en el contenedor, no en la tapa.93
El tiempo transcurrido entre la micción y el examen de orina es crítico para lograr un diagnóstico preciso. Los análisis realizados en el punto de atención no están sujetos a este retraso, pero pueden sufrir problemas analíticos por falta de condiciones y especificaciones necesarias en el sitio del análisis. Los tiempos precisos de recolección deben documentarse y los retrasos que excedan los límites especificados deben indicarse en los informes. Para muchos componentes químicos examinados con tiras reactivas no se necesitan conservantes, siempre que el análisis se realice dentro de las primeras dos horas (preferentemente entre 90 y 120 minutos).94-96
Para el examen del sedimento, la muestra debe refrigerarse si no se examina en un período máximo de una hora, aunque en algunas muestras se producirá precipitación de uratos y fosfatos. Si la precipitación interfiere la interpretación, se debe examinar un nuevo espécimen a 20º C para evitar su generación de artefactos. Cuanto más largo sea el retraso, más probable es que haya elementos para lisar, especialmente cuando el pH urinario es alcalino y la densidad relativa es baja (especialmente con los especímenes de neonatos y pediátricos sin control de esfínter, que a menudo producen una gran diuresis).
Los recuentos de glóbulos blancos pueden ser cuestionables después de 2-4 horas, incluso con refrigeración.96
Las muestras que sean procesadas para realizar lectura de sedimento urinario deberán centrifugarse a una velocidad de 400 G x 5 min.45 Con el fin de eliminar el riesgo de perder lo elementos formes (células, cristales, cilindros) que pueden ser susceptibles de destrucción por una centrifugación a altas velocidades.45
El uroanálisis es uno de los análisis de laboratorio más frecuentes. Es de vital importancia para el diagnóstico y monitoreo de las enfermedades de vías urinarias, para aportar datos importantes de otros órganos y tejidos, así como de condiciones exógenas y del estado fisiológico, fisiopatológico o patológico de los pacientes. La utilización de la metodología correcta para esta toma de muestras es imprescindible para tener resultados confiables.
Como un resumen y puntos básicos que el lector debe recordar hemos incluido los siguientes mensajes clave:
- Las condiciones generales del paciente antes de la toma de muestra urinaria deben tomar en cuenta la dieta, el consumo de líquidos, el tiempo de ayuno y el ejercicio realizado recientemente.
- Para evitar la contaminación de la muestra se debe informar a los pacientes que no deben tener relaciones sexuales al menos tres días antes de la toma de muestra. También se debe indicar al paciente cómo recolectar orina de chorro medio mediante un procedimiento aséptico. En el caso de niños sin control de esfínteres existe un procedimiento de limpieza y recolección en bolsa que se debe seguir.
- Existen procedimientos para la toma de muestras con catéter vesical, por urostomía, por punción suprapúbica y de recolección de 24 horas que se deben aplicar.
- El personal encargado de la toma de muestra urinaria debe estar debidamente capacitado y conocer perfectamente los procedimientos anteriores, además de los procedimientos de rotulado, uso de contenedores, manejo y conservación de la muestra.
- Todo el personal involucrado debe recordar que el cuidado y apego a procedimientos en esta fase preanalítica afecta los resultados de laboratorio de los cuales dependen las decisiones clínicas y terapéuticas y, por ende, la salud y la vida de los pacientes.
En nuestro país carecemos de guías y normas para este muestreo, esperamos que la presente Guía de práctica clínica para toma de muestra urinaria en México y su subsecuente difusión contribuya a estandarizar criterios en beneficio de los pacientes y optimización de recursos en salud.
Los autores agradecen al Equipo de Trabajo de las Guías de Toma de muestras en México:
Dr. Juan Miguel Terán Soto, LE. Martha Asunción Huertas Jiménez, Quím. Aurora Muñoz Pedraza, Quím. Guadalupe Ivonne Villalobos Zapata, Quím. EHDL. Martín Eduardo Ureña Reyes, Quím. Carolina Rodríguez Padilla, Dra. Roxana Trejo González, Quim. Ixchel de la Luz Martínez, M.C. Beatriz Cedillo Carvallo, LE Patricia Gómez Lara, Mtro. José Antonio Duarte García, Mtra. Christian Alejandra Escobedo, Dr. Alfredo Salmon Demongin.
| 1. | Siener R, Hesse A. The Effect of different diets on urine composition and the risk of calcium oxalate crystallisation in healthy subjects. Eur Urol. 2002;42(3):289-96. |
| 2. | US Department of Health and Human Services. 2015-2020 Dietary Guidelines. Available from URL: https://health.gov/our-work/nutrition-physical-activity/dietary-guidelines/previous-dietary-guidelines/2015 |
| 3. | Pradella M, Dorizzi RM, Rigolin F. Relative density of urine: Methods and clinical significance. Crit Rev Clin Lab Sci. 1988;26(3):195-242. |
| 4. | Scientific opinion on dietary reference values for water. EFSA Panel on dietetic products, nutrition, and allergies (NDA). European Foods Safety Authorities 2010. Available from URL: https://efsa.onlinelibrary.wiley.com/doi/epdf/10.2903/j.efsa.2010.1459 |
| 5. | Dorizzi RM, Caputo M. Measurement of urine relative density using refractometer and reagent strips. Clin Chem Lab Med. 1998;36(12):925-8. |
| 6. | Chadha V, Garg U, Alon US. Measurement of urinary concentration: A critical appraisal of methodologies. Pediatr Nephrol. 2001;16(4):374-82. |
| 7. | ISAACSON LC. Urinary osmolality and specific gravity. Lancet. 1959;1(7063):72-3. |
| 8. | Dörner K, Campos R, Börnsen S. Further evaluation of the SG test strip for estimation of urinary osmolality. J Clin Chem Clin Biochem. 1984;22(6):419-25. |
| 9. | Fomina EV, Lisova NI, Kireev KS, Tiys ES, Kononikhin AS, Larina IM. Kidney function and urine protein composition in healthy volunteers during space station fitness tests. Aerosp Med Hum Perform. 2015;86(5):472-6. |
| 10. | Poortmans JR, Brauman H, Staroukine M, Verniory A, Decaestecker C, Leclercq R. Indirect evidence of glomerular/tubular mixed-type postexercise proteinuria in healthy humans. Am J Physiol. 1988;254(2 Pt 2):F277-83. |
| 11. | Poortmans JR. Exercise and renal function. Sports Med. 1984;1(2):125-53. |
| 12. | Fortney SM, Schneider VS, Greenleaf JE. The physiology of bed rest. Supplement 14, Handbook of Physiology. Environmental Physiology, Wiley Online Library, 2011. Available from URL: http://doi.wiley.com/10.1002/cphy.cp040239 |
| 13. | Poortmans JR, Vanderstraeten J. Kidney function during exercise in healthy and diseased humans. An update. Sports Med. 1994;18(6):419-37. |
| 14. | Bankir L. Urea and the kidney. In: Brenner BM Rector Jr FC, editor. The Kidney. 5th edition. Philadelphia: WB Saunders Company; 1986. p. 571-606. |
| 15. | Wyss M, Kaddurah-Daouk R. Creatine and creatinine metabolism. Physiol Rev. 2000; 80(3):1107-213. |
| 16. | Zorbas YG, Verentsov GE. Blood urea content changes in man under hypokinesia. Biochem Med Metab Biol. 1986;36(3):267-75. |
| 17. | Nygren J, Thorell A, Brismar K, Karpe F, Ljungqvist O. Short-term hypocaloric nutrition but not bed rest decrease insulin sensitivity and IGF-I bioavailability in healthy subjects: The importance of glucagon. Nutrition. 1997;13(11-12):945-51. |
| 18. | Millet C, Custaud MA, Maillet A, Allevard AM, Duvareille M, Gauquelin-Koch G, et al. Endocrine responses to 7 days of head-down bed rest and orthostatic tests in men and women. Clin Physiol. 2001;21(2):172-83. |
| 19. | Blanc S, Normand S, Ritz P, Pachiaudi C, Vico L, Gharib C, et al. Energy and water metabolism, body composition, and hormonal changes induced by 42 days of enforced inactivity and simulated weightlessness. J Clin Endocrinol Metab. 1998;83(12):4289-97. |
| 20. | Bilancio G, Lombardi C, Pisot R, De Santo NG, Cavallo P, Cirillo M. Effects of bed-rest on urea and creatinine: Correlation with changes in fat-free mass. PLoS One. 2014;9(9):e108805. |
| 21. | Bentur L, Alon U, Berant M. Hypercalciuria in chronically institutionalized bedridden children: Frequency, predictive factors and response to treatment with thiazides. Int J Pediatr Nephrol. 1987;8(1):29-34. |
| 22. | Wang J, Zheng X, Zhang L, Zhang Y, Xiong J, Cheng Y, et al. The variation in urinary calcium levels in adult patients with fracture and surgical intervention. J Orthop Surg Res. 2017;12(1):123. |
| 23. | European Association of Urology. Guidelines on urological infections 2022. Available from URL: https://uroweb.org/guideline/urological-infections/?type=archive// Available from URL: https://d56bochluxqnz.cloudfront.net/documents/full-guideline/EAU-Guidelines-on-Urological-Infections-2022.pdf |
| 24. | Lundberg JO, Carlsson S, Engstrand L, Morcos E, Wiklund NP, Weitzberg E. Urinary nitrite: More than a marker of infection. Urology. 1997;50(2):189-91. |
| 25. | Carlsson S, Wiklund NP, Engstrand L, Weitzberg E, Lundberg JO. Effects of pH, nitrite, and ascorbic acid on nonenzymatic nitric oxide generation and bacterial growth in urine. Nitric Oxide. 2001;5(6):580-6. |
| 26. | Tsikas D. Methods of quantitative analysis of the nitric oxide metabolites nitrite and nitrate in human biological fluids. Free Radic Res. 2005;39(8):797-815. |
| 27. | Khasriya R, Sathiananthamoorthy S, Ismail S, Kelsey M, Wilson M, Rohn JL, et al. Spectrum of bacterial colonization associated with urothelial cells from patients with chronic lower urinary tract symptoms. J Clin Microbiol. 2013;51(7):2054-62. |
| 28. | Bondonno CP, Liu AH, Croft KD, Ward NC, Puddey IB, Woodman RJ, et al. Short-term effects of a high nitrate diet on nitrate metabolism in healthy individuals. Nutrients. 2015;7(3):1906-15. |
| 29. | Kidney Disease: Improving Global Outcomes (KDIGO) Hepatitis C Work Group. KDIGO 2018 clinical practice guideline for the prevention, diagnosis, evaluation, and treatment of hepatitis C in chronic kidney disease. Kidney Int Suppl (2011). 2018;8(3):91-165. |
| 30. | Harpole M, Davis J, Espina V. Current state of the art for enhancing urine biomarker discovery. Expert Rev Proteomics. 2016;13(6):609-26. |
| 31. | Agbugui JO, Obarisiagbon EO, Osaigbovo II. Bacteriology of urine specimens obtained from men with symptomatic benign prostatic hyperplasia. Niger J Surg. 2016;22(2):65-9. |
| 32. | Drake RR, White KY, Fuller TW, Igwe E, Clements MA, Nyalwidhe JO, et al. Clinical collection and protein properties of expressed prostatic secretions as a source for biomarkers of prostatic disease. J Proteomics. 2009;72(6):907-17. |
| 33. | Sumati AH, Saritha NK. Association of urinary tract infection in women with bacterial vaginosis. J Glob Infect Dis. 2009;1(2):151-2. |
| 34. | Sharami SH, Afrakhteh M, Shakiba M. Urinary tract infections in pregnant women with bacterial vaginosis. J Obstet Gynaecol. 2007;27(3):252-4. |
| 35. | Lewis AL, Lewis WG. A new catalog of microbiological tools for women’s infectious disease research. Genome Announc. 2016;4(5):e00890-16. |
| 36. | Król J, Zarski D, Bernáth G, Palinska-Zarska K, Krejszeff S, Dlugonski A, et al. Effect of urine contamination on semen quality variables in Eurasian perch Perca fluviatilis L. Anim Reprod Sci. 2018;197:240-6. |
| 37. | Vazquez-Levin MH, Dressler KP, Nagler HM. Urine contamination of seminal fluid after transurethral resection of the ejaculatory ducts. J Urol. 1994;152(6 Pt 1):2049-52. |
| 38. | Ellerbrock R, Canisso I, Feijo L, Lima F, Shipley C, Kline K. Diagnosis and effects of urine contamination in cooled-extended stallion semen. Theriogenology. 2016;85(7):1219-24. |
| 39. | DOF - Diario Oficial de la Federación. Proyecto de Norma Oficial Mexicana PROY-NOM-007-SSA3-2017, Para la organización y funcionamiento de los laboratorios clínicos. - 31 de Enero de 2018 - DOF. Diario Oficial de la Federación - Legislación - VLEX 701928609,2017. Disponible en URL: https://dof.vlex.com.mx/vid/proyecto-norma-oficial-mexicana-701928609 |
| 40. | LaRocco MT, Franek J, Leibach EK, Weissfeld AS, Kraft CS, Sautter RL, et al. Effectiveness of preanalytic practices on contamination and diagnostic accuracy of urine cultures: A laboratory medicine best practices systematic review and meta-analysis. Clin Microbiol Rev. 2016;29(1):105-47. |
| 41. | Bekeris LG, Jones BA, Walsh MK, Wagar EA. Urine culture contamination: A College of American Pathologists Q-Probes study of 127 laboratories. Arch Pathol Lab Med. 2008;132(6):913-7. |
| 42. | Holliday G, Strike PW, Masterton RG. Perineal cleansing and midstream urine specimens in ambulatory women. J Hosp Infect. 1991;18(1):71-5. |
| 43. | Walter FG, Knopp RK. Urine sampling in ambulatory women: Midstream clean-catch versus catheterization. Ann Emerg Med. 1989;18(2):166-72. |
| 44. | Blake DR, Doherty LF. Effect of perineal cleansing on contamination rate of mid-stream urine culture. J Pediatr Adolesc Gynecol. 2006;19(1):31-4. |
| 45. | European Confederation of Laboratory Medicine. European urinalysis guidelines. Scand J Clin Lab Investig Suppl. 2000;60(231):1-86. |
| 46. | Lozano JA. Infecciones del tracto urinario. Offarm. 2003;22(11):96-100. Disponible en URL: https://www.elsevier.es/es-revista-offarm-4-articulo-infecciones-del-tracto-urinario-13055924 |
| 47. | Piera Fernández M. Infecciones urinarias. Prevención y tratamiento. Farm Prof. 2003;17(6):40–5. Disponible en URL: https://www.elsevier.es/es-revista-farmacia-profesional-3-articulo-infecciones-urinarias-prevencion-tratamiento-13049604 |
| 48. | Alam MT, Coulter JBS, Pacheco J, Correia JB, Ribeiro MGB, Coelho MFC, et al. Comparison of urine contamination rates using three different methods of collection: Clean-catch, cotton wool pad and urine bag. Ann Trop Paediatr. 2005;25(1):29-34. |
| 49. | Vaillancourt S, McGillivray D, Zhang X, Kramer MS. To clean or not to clean: Effect on contamination rates in midstream urine collections in toilet-trained children. Pediatrics. 2007;119(6):e1288-93. |
| 50. | Ramage IJ, Chapman JP, Hollman AS, Elabassi M, McColl JH, Beattie TJ. Accuracy of clean-catch urine collection in infancy. J Pediatr. 1999;135(6):765-7. |
| 51. | Morton RE, Lawande R. The diagnosis of urinary tract infection: Comparison of urine culture from suprapubic aspiration and midstream collection in a children’s out-patient department in Nigeria. Ann Trop Paediatr. 1982;2(3):109-12. |
| 52. | Etoubleau C, Reveret M, Brouet D, Badier I, Brosset P, Fourcade L, et al. Moving from bag to catheter for urine collection in non-toilet-trained children suspected of having urinary tract infection: A paired comparison of urine cultures. J Pediatr. 2009;154(6):803-6. |
| 53. | Hardy JD, Furnell PM, Brumfitt W. Comparison of sterile bag, clean catch and suprapubic aspiration in the diagnosis of urinary infection in early childhood. Br J Urol. 1976;48(4):279-83. |
| 54. | Cohen HA, Woloch B, Linder N, Vardi A, Barzilai A. Urine samples from disposable diapers: An accurate method for urine cultures. J Fam Pract. 1997;44(3):290-2. |
| 55. | Royal College of Nursing. The Voice of Nursing. Atheter care. Guidance for health cara professionals. Available from URL: https://www.rcn.org.uk/professional-development/publications/catheter-care-guidance-for-health-care-professionals-uk-pub-009-915 |
| 56. | Clinical Excellence Commission. Reducing catheter associated urinary tract infections. Quick guide on urine culture during catheterisation, 2015. Available from URL: http://www.cec.health.nsw.gov.au/__data/assets/pdf_file/0003/289146/UrineSpecimenCollectionDecisionSupportToolQuickGuide.pdf |
| 57. | College of American Pathologists. Urine Collection Manual 2020-2022. Available from URL: https://www.hamad.qa/EN/Hospitals-and-services/Hamad-General-Hospital/Hospital-Services/Clinical-Departments/Documents/Urine%20Collection%20Procedure%20%20Manual%20-%202018-2020-%20for%20lab%20guide.pdf#search=Urine%20guidelines |
| 58. | Loveday HP, Wilson JA, Pratt RJ, Golsorkhi M, Tingle A, Bak A, et al. epic3: National evidence-based guidelines for preventing healthcare-associated infections in NHS hospital in England. J Hosp Infect. 2014;86 Suppl 1:S1-S70. |
| 59. | Secretaría de Salud. Dirección General de Calidad y Educación en Salud. Comisión Permanente de Enfermería. Procedimiento para el cuidado del paciente con sonda vesical durante la instalación, mantenimiento, retiro y detección de casos enfocados a la prevención de IAAS. Disponible en URL: http://www.calidad.salud.gob.mx/site/editorial/docs/procedimiento_sonda_vesical.pdf |
| 60. | Shepherd E. Specimen collection 2: Obtaining a catheter specimen of urine. Nurs Times. 2017;113(8):29-31. |
| 61. | Cabrera Dueñas A, Camacho Cerezo N, Cano Berenjena M, Espinosa Vargas J, Florez Almonacid CI, Galisteo Rey P, et al. Manual de protocolos y procedimientos generales de enfermería. Hospital Universitario Reina Sofía. Abril 2011. Disponible en URL: https://www.sspa.juntadeandalucia.es/servicioandaluzdesalud/hrs3/fileadmin/user_upload/area_enfermeria/enfermeria/procedimientos/procedimientos_2012/rd7_obtencion_muestras_orina.pdf |
| 62. | Mahoney M, Baxter K, Burgess J, Bauer C, Downey C, Mantel J, et al. Procedure for obtaining a urine sample from a urostomy, ileal conduit, and colon conduit: A best practice guideline for clinicians. J Wound Ostomy Continence Nurs. 2013;40(3):277–9; quiz E1-2. |
| 63. | Wound, Ostomy, and Continence Nurses Society (WOCN). Catheterization of an Ileal or Colon Conduit Stoma: Best Practice for Clinicians. Available from URL: https://www.ostomy.org/wp-content/uploads/2021/04/Catheterization-of-Urinary-Stoma-2018.pdf |
| 64. | Akbari A, Clase CM, Acott P, Battistella M, Bello A, Feltmate P, et al. Canadian Society of Nephrology commentary on the KDIGO clinical practice guideline for CKD evaluation and management. Am J Kidney Dis. 2015;65(2):177-205. |
| 65. | Chu RWP, Wong YC, Luk SH, Wong SN. Comparing suprapubic urine aspiration under real-time ultrasound guidance with conventional blind aspiration. Acta Paediatr. 2002;91(5):512-6. |
| 66. | García-Nieto V, Navarro JF, Sánchez-Almeida E, García-García M. Standard for ultrasound guidance of suprapubic aspiration. Pediatr Nephrol. 1997:11(5):607-9. |
| 67. | Hansson S, Bollgren, Esbjorner E, Jakobsson B, Marild S. Urinary tract infecition in children below two years of age: A quality assurance project n Sweden. The Swedish Pediatric Nephrology Association. Acta Paediatr. 1999;88(3):270-4. |
| 68. | Marban SL. Suprapubic bladder aspiration. In: Fletcher MA, MacDonald MG, editors. Atlas of Procedures in Neonatology. 2nd ed. Lippincott company 1993;p. 118-20. |
| 69. | Roberts WB. Procedures. Suprapubic bladder aspiration. In: Siberry GK, Iannone R, editors. The Harriet Lane Handbook. The Johns Hopkins Hospital. 15th ed. Mosby, 2000;p. 63-4. |
| 70. | Nickel CJ. Inflammatory and pain conditions of the male genitourinary tract: prostatitis and related pian conditions, orchitis, and epididyymitis. In: Wein W, Kavoussu L PA, editor. Campbell-Walsh urology. 11th ed. Philadelphia, PA: Elsevier; 2016. |
| 71. | McNaughton Collins M, Fowler FJ Jr, Elliott DB, Albertsen PC, Barry MJ. Diagnosing and treating chronic prostatitis: Do urologists use the four-glass test? Urology. 2000;55(3):403-7. |
| 72. | Nickel JC. The pre and post massage test (PPMT): A simple screen for prostatitis. Tech Urol. 1997;3(1):38-43. |
| 73. | Nickel JC. Rational management of non-bacterial prostatitis and prostatodynia. Curr Opin Urol. 1996;6(1):53-8. Available from URL: https://journals.lww.com/co-urology/Abstract/1996/01000/Rational_management_of_non_bacterial_prostatitis.12.aspx |
| 74. | Meares EM, Stamey TA. Bacteriologic localization patterns in bacterial prostatitis and urethritis. Invest Urol. 1968;5(5):492-518. |
| 75. | Bingham SA, Gill C, Welch A, Cassidy A, Runswick SA, Oakes S, et al. Validation of dietary assessment methods in the UK arm of EPIC using weighed records, and 24-hour urinary nitrogen and potassium and serum vitamin C and carotenoids as biomarkers. Int J Epidemiol. 1997;26 Suppl 1:S137-51. |
| 76. | Neuhouser ML, Tinker L, Shaw PA, Schoeller D, Bingham SA, Van Horn L, et al. Use of recovery biomarkers to calibrate nutrient consumption self-reports in the Women’s Health Initiative. Am J Epidemiol. 2008;167(10):1247-59. |
| 77. | Prentice RL, Mossavar-Rahmani Y, Huang Y, Van Horn L, Beresford SAA, Caan B, et al. Evaluation and comparison of food records, recalls, and frequencies for energy and protein assessment by using recovery biomarkers. Am J Epidemiol. 2011;174(5):591-603. |
| 78. | Schatzkin A, Kipnis V, Carroll RJ, Midthune D, Subar AF, Bingham S, et al. A comparison of a food frequency questionnaire with a 24-hour recall for use in an epidemiological cohort study: Results from the biomarker-based Observing Protein and Energy Nutrition (OPEN) study. Int J Epidemiol. 2003;32(6):1054-62. |
| 79. | Mundt LA, Shanahan K. Graff’s Textbook of Routine Urinalysis and Body Fluids. 2nd Edition. Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins Health, 2011. |
| 80. | Thierauf A, Serr A, Halter CC, Al-Ahmad A, Rana S, Weinmann W. Influence of preservatives on the stability of ethyl glucuronide and ethyl sulphate in urine. Forensic Sci Int. 2008;182(1-3):41-5. |
| 81. | Herrington W, Illingworth N, Staplin N, Kumar A, Storey B, Hrusecka R, et al. Effect of processing delay and storage conditions on urine albumin-to-creatinine ratio. Clin J Am Soc Nephrol. 2016;11(10):1794-1801. |
| 82. | Lee EJ, Arbuckle TE. Urine-sampling methods for environmental chemicals in infants and young children. J Expo Sci Environ Epidemiol. 2009;(7):625-33. |
| 83. | Salazar-García S, Lares-Villaseñor E, Bárcenas-Morales A, Vargas-Morales JM. Impact of chemical preservative in urine simples. EJIFCC. 2020; 31(1):56-64. |
| 84. | National Center for Biotechnology Information. PubChem Compound Summary for CID 8434, Ethylparaben (2022). Available from URL: https://pubchem.ncbi.nlm.nih.gov/compound/Ethylparaben |
| 85. | National Center for Biotechnology Information. PubChem Compound Summary for CID 2723816, Sodium propionate (2022). Available from URL: https://pubchem.ncbi.nlm.nih.gov/compound/Sodium-propionate |
| 86. | Hoppin JA, Ulmer R, Calafat AM, Barr DB, Baker SV, Meltzer HM, et al. Impact of urine preservation methods and duration of storage on measured levels of environmental contaminants. J Expo Sci Environ Epidemiol. 2006;16(1):39-48. |
| 87. | Council of Europe. European Pharmacopoeia 1999 Supplement: 1999 Supplement to the third edition [Internet]. European Pharmacopoeia Com; 1998. |
| 88. | Kunin CM, White LV, Hua TH. A reassessment of the importance of “low-count” bacteriuria in young women with acute urinary symptoms. Ann Intern Med. 1993;119(6):454-60. |
| 89. | Delanghe JR, Speeckaert MM. Preanalytics in urinalysis. Clin Biochem. 2016; 49(18):1346-50. |
| 90. | Stankovic AK, DiLauri E. Quality improvements in the preanalytical phase: Focus on urine specimen workflow. Clin Lab Med. 2008;28(2):339-50, viii. |
| 91. | Holm A, Aabenhus R. Urine sampling techniques in symptomatic primary-care patients: A diagnostic accuracy review. BMC Fam Pract. 2016;17:72. |
| 92. | Coppens A, Speeckaert M, Delanghe J. The pre-analytical challenges of routine urinalysis. Acta Clin Belg. 2010;65(3):182-9. |
| 93. | Clinical and Laboratory Standards Institute (CLSI). Urianalysi; Approved Guideline – Third Edition. CLSI document GP16-A3, 2009. Available from URL: https://clsi.org/media/3752/gp16_archived_sample.pdf |
| 94. | Bouatra S, Aziat F, Mandal R, Guo AC, Wilson MR, Knox C, et al. The human urine metabolome. PLoS One. 2013;8(9):e73076. |
| 95. | Xiao Y, Wang M HS. Urine metabolites for two preservatives, boric acid and sodium azide: UPLC/Q-TOF MS/MS analyses. Carcinog Teratog Mutagen. 2018;30(6):442-51. Available from URL: https://www.egh.net.cn/EN/10.3969/j.issn.1004-616x.2018.06.005 |
| 96. | Bingham S, Cummings JH. The use of 4-aminobenzoic acid as a marker to validate the completeness of 24 h urine collections in man. Clin Sci (Lond). 1983;64(6):629-35. |
All Rights Reserved® 2019
Latin American Journal of Clinical Sciences and Medical Technology,Publicación contínua • Editor responsable: Gilberto Castañeda Hernández. • Reserva de Derechos al Uso Exclusivo: 04-2019-062013242000-203; ISSN: 2683-2291; ambos otorgados por el Instituto Nacional del Derecho de Autor. • Responsable de la última actualización de este número, Web Master Hunahpú Velázquez Martínez,
Calle Profesor Miguel Serrano #8, Col. Del Valle, Alcaldía Benito Juárez, CP 03100, Ciudad de México, México. Número telefónico: 55 5405 1396 • Fecha de última modificación, 28 de agosto de 2024.
All Rights Reserved® 2019
Publicación contínua • Editor responsable: Gilberto Castañeda Hernández. • Reserva de Derechos al Uso Exclusivo: 04-2019-062013242000-203; ISSN: 2683-2291; ambos otorgados por el Instituto Nacional del Derecho de Autor. • Responsable de la última actualización de este número, Web Master Hunahpú Velázquez Martínez,
Calle Profesor Miguel Serrano #8, Col. Del Valle, Alcaldía Benito Juárez, CP 03100, Ciudad de México, México. Número telefónico: 55 5405 1396 • Fecha de última modificación, 28 de agosto de 2024.